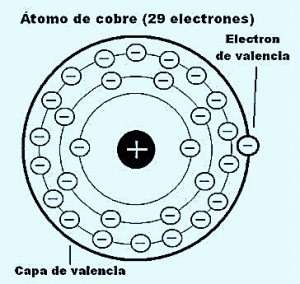
Electrón de valencia
Electrones de Valencia. Son los electrones que se encuentran en la última capa electrónica (denominada orbitales de valencia) y tienen muchas posibilidades de participar en una reacción química. Estos electrones poseen el número cuántico principal n más alto. Tienen vital importancia en la formación de moléculas y compuestos ya que determinan la capacidad del átomo para formar enlaces. Cuando un elemento se une a otro lo hace a través de sus electrones de valencia.
También se puede decir que estos electrones son los electrones más alejados al núcleo del átomo, y en consecuencia los que pueden participar comúnmente en la formación de enlaces químicos.
Sumario
Orbitales de Valencia o Capa de Valencia
Es el lugar donde se encuentran ubicados los electrones de valencia, corresponde al último nivel del átomo. O más bien lo que sería el orbital más lejano. En esta imagen se puede apreciar claramente cuales son los electrones de valencia.
Propiedades y características
Como mencionamos atrás, estos electrones de valencia son determinantes en la reactividad de un elemento, ya que determinan la facilidad con la que los elementos se unen a otros para formar un nuevo compuesto en cuestión.
Si observamos la capa de valencia de un gas noble, veremos que se encuentra completamente llena, entonces, este átomo no tiende a ganar ni perder electrones. Por este motivo se dice que los gases nobles no reaccionan en condiciones normales,o sea son inertes. Generalmente, los elementos en los Grupos 1, 2, y 13 a 17 tienden a reaccionar para obtener una configuración electrónica similar al del gas noble más cercano, cuya configuración electrónica es ns2 np6.
Por ejemplo los metales más reactivos, como lo son los del grupo 1 y 2 necesitan perder solo uno o dos electrones de valencia para formar cationes, y de esta manera obtener una configuración electrónica del gas noble más cercano. Los no metales tienden a atraer electrones de valencia adicionales para formar enlaces iónicos o covalentes.
Los no metales más reactivos son los halógenos (elementos del grupo 7), como el Flúor y Cloro. Ambos tienen una configuración muy cercana a la del gas noble y necesitan únicamente un electrón de valencia para completar su octeto, por eso lo halógenos tienden aceptar dicho electrón proveniente de los metales alcalinos.
Tabla Periódica con valencias
En la tabla periódica los elementos se organizan según sus propiedades químicas y físicas de los elementos en función de su número atómico. En la siguiente tabla se puede apreciar la valencia química de algunos elementos, no es necesario aprenderlos a todos. Solo los mas básicos, como la valencia del carbono, oxígeno, nitrógeno, azufre, boro, cloro, los del grupo uno y dos, ya que estos se utilizan normalmente como base de estudio para el Enlace Químico.
Hay dieciocho columnas verticales que se denominan Grupos y siete filas horizontales llamadas periodos. Todos los elementos de un mismo grupo poseen el mismo número de electrones de valencia (Esto no ocurre en los metales de transición). Los electrones de valencia aumentan en número a medida que se avanza en un período. Luego, al comenzar el nuevo período, el número disminuye a uno y comienza a aumentar de nuevo.
Por ejemplo, cuando en la tabla periódica se pasa del carbono al nitrógeno, y luego hacia el oxígeno, el número de electrones de valencia aumenta de 4 a 5 y luego a 6.
A medida que pasamos del flúor al neón y luego al sodio, el número de electrones de valencia aumenta de 7 a 8 y luego baja a 1 cuando comenzamos con el periodo del sodio.
Utilidad
Cuando los átomos forman enlaces, solamente lo hacen a través de sus electrones más externos, aquellos que se ubican en el último nivel de energía, denominados electrones de valencia. Los electrones de valencia son los que permiten que se dé la reacción de un átomo con otro, ya sea del mismo elemento o de elementos diferentes, ya que tienen la facilidad o predisposición para participar en los enlaces
Algunas valencias de los elementos químicos
Número de valencia del carbono: 4
Número de valencia del Oxigeno: 6
Número de valencia del Nitrógeno: 5
Número de valencia del Azufre: 6
Número de valencia del Cloro: 7
Número de valencia del Fósforo: 5
Fuentes
- Química general -Libro de Ralph H. Petrucci
- Lic. Irene Vera, Maria: Química General, Unidad III: Distribución de electrones en los átomos. Disponible en: http://exa.unne.edu.ar
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985