Fisiología del corazón
| ||||
Fisiología del corazón. Gracias al estudio del médico valenciano Francisco Torrent y Guasp se ha podido conocer mejor, la formación (en términos evolutivos), y funcionamiento a nivel mecánico del corazón. El doctor Torrent y Guasp descubrió, gracias a sus investigaciones, que la parte ventricular del corazón era una banda con continuidad muscular que se replegaba sobre ella misma en forma de hélice durante el desarrollo embrionario, esto es, que el corazón es un músculo enrollado sobre si mismo.
Sumario
- 1 Sistema de conducción
- 2 Excitabilidad cardíaca
- 3 Bases celulares de la contracción cardíaca
- 4 Mecanismos de la contracción cardíaca
- 5 Ciclo cardíaco.
- 6 Presión arterial.
- 7 Regulación de la presión arterial
- 8 Fisiología del eje renina-angiotensina- aldosterona
- 9 Adaptabilidad al ejercicio
- 10 Fuentes
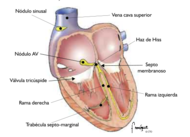
Sistema de conducción
Está formado por células cardíacas especializadas en la génesis y conducción del impulso eléctrico cardíaco.
- Nódulo sinoauricular (Keith-Flack): situado en el surco terminal en el techo de la aurícula derecha, junto a la desembocadura de la vena cava superior.
- Nódulo aurículoventricular (Aschoff-Tawara): está en la porción inferior del surco interauricular próximo al septo membranoso interventricular, en el vértice superior del triángulo de Koch (espacio entre el seno coronario, la valva septal tricuspídea y el tendón de Todaro).
- Haz de His: atraviesa el trígono fibroso derecho y la pars membranosa del septo, para dividirse después en dos ramas (izquierda y derecha). La rama derecha discurre por la trabécula septomarginal.
- La red ventricular final es subendocárdica, denominándose fibras de Purkinje.
Las células del sistema de conducción tienen la capacidad de despolarizarse espontáneamente, es decir, automatismo (y generar un frente de despolarización). La frecuencia de despolarización del nodo sinusal es la mayor (60-100 por minuto en reposo), la del nodo AV-His es menor (40-60) y la del sistema de Purkinje aún más baja (20-30). Por eso normalmente el marcapasos del corazón es el nodo sinusal (MIR 96-97F, 225), pero en bradicardias o bloqueos AV aparecen ritmos de escape de las otras estructuras más “bajas”.
El impulso eléctrico que nace en el nodo sinusal se conduce a las aurículas por unas vías preferenciales, entre las que destaca el Haz de Bachmann que lo comunica con la aurícula izquierda, y para pasar a los ventrículos atravesando el anillo fibroso aurículoventricular (que es un “aislante” eléctrico) sólo puede hacerlo por la “puerta” del nodo AV-His (donde sufre un retraso en la conducción para permitir un apropiado llenado ventricular), siguiendo luego por sus ramas hacia los ventrículos.
Excitabilidad cardíaca
Los canales iónicos son proteínas transmembranosas que presentan un poro a través del cual permiten el paso a un ión determinado. En situación de reposo están cerrados. Su activación (apertura) viene determinada por un cambio en su conformación proteica en respuesta a estímulos específicos (cambios en el voltaje transmembrana: voltaje-dependientes, ciertos ligandos como adenosina, acetilcolina...) Tras permanecer abiertos un tiempo determinado sufren un nuevo cambio de conformación que los inactiva (cierra el poro), pero aún tardarán un tiempo en recuperar su conformación original de reposo, tal que hasta que lo hagan el canal no puede volver a activarse (abrirse) y por tanto a despolarizar la célula (período refractario absoluto). Los fármacos antiarrítmicos interaccionan con estos canales.
El interior de las células cardíacas en reposo es electronegativo y el exterior positivo, de tal forma que se establece un potencial de membrana en reposo de unos -80 a -100 mV, es decir, que las células están polarizadas. Este potencial de membrana se mantiene gracias a la bomba Na+/K+ ATP-dependiente que saca de la célula tres iones Na+ e introduce dos iones K+, de forma que el Na+ está muy concentrado fuera de las células y poco en su interior (al contrario que el K+).
Para que el corazón se contraiga, es necesario que sus células musculares reciban un estímulo eléctrico. Este se genera en células especializadas (células marcapaso) del sistema de conducción que originan el impulso eléctrico por sufrir despolarizaciones espontáneas (automatismo).
Cuando el potencial de membrana asciende hasta un “potencial umbral” (de unos -60 mV, tal que si el potencial de membrana no llega al umbral no se produce el potencial de acción: ley del “todo o nada”), se abren los canales rápidos de Na+ y permiten la entrada rápida de grandes cantidades de Na+ por difusión facilitada (MIR 99-00F, 225), de forma que el potencial de membrana se acerca a cero (pierde la polaridad negativa) e incluso se hace un poco positivo; esta es la despolarización rápida o fase 0 del potencial de acción (MIR 03-04, 162). Durante las fases 1 y 2 ó meseta, tiene lugar sobre todo una salida breve inicial de potasio y posterior entrada lenta de calcio tal que se mantiene el potencial de membrana ligeramente positivo durante un tiempo (MIR 98-99F, 227). La fase 3 ó repolarización está producida sobre todo por la salida de K+ y se caracteriza por el restablecimiento del potencial de membrana en reposo, de unos -90 mV. En la fase 4 la célula recupera el equilibrio iónico a ambos lados de la membrana gracias a la bomba Na+/K+ ATP-dependiente y queda preparada para una nueva despolarización.
Las células marcapaso de los nodos sinusal y AV poseen unos mecanismos iónicos algo diferentes al resto. En estado de reposo su potencial de membrana es menos negativo (-55mV), por lo que los canales de sodio están inactivados. Por eso el potencial de acción sólo puede producirse por los canales de calcio y por canales lentos de sodio, por lo que la despolarización y la repolarización son más lentas que en el resto de células. Además en las células del sistema de conducción a excepción del nodo AV compacto durante la fase 4 se produce una entrada lenta de Na+ que produce una positivización progresiva del potencial de membrana (fase 4 ó despolarización lenta), y al alcanzar el potencial umbral (unos -40 mV en los nodos y unos -60 mV en la red de Purkinje) se genera un nuevo potencial de acción, lo que justifica el automatismo. La pendiente de esta fase 4 determinará el tiempo que tarda en llegar al potencial umbral, de forma que es más “empinada” cuanto más “arriba” nos encontremos en el sistema de conducción, y por eso es el nodo sinusal el marcapasos normal del corazón. La fase 4 está muy influenciada por el sistema nervioso autónomo fundamentalmente en ambos nodos, de forma que el simpático aumenta y el parasimpático disminuye la pendiente de la fase 4 y por tanto la frecuencia de despolarización automática, así como la velocidad de conducción del impulso a través del nodo AV-His.
La señal eléctrica de despolarización se transmite de una célula a las adyacentes por la presencia de uniones GAP, de forma que la velocidad de conducción del impulso es mucho más rápida en sentido longitudinal que transversal. Las células del sistema His-Purkinje están especializadas en transmitir el impulso a gran velocidad. El nodo AV es una estructura histológica compleja con tres partes, transicional (entre la aurícula y el nodo compacto), compacta (cuya principal función es retrasar o frenar la conducción del impulso) y el nodo-His (con capacidad automática muy dependiente de canales de calcio).
Bases celulares de la contracción cardíaca
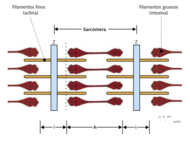
El miocardio está formado por células musculares estriadas, que contienen muchas fibrillas paralelas. Cada fibrilla está formada por estructuras que se repiten en serie, las sarcómeras, que son la unidad de contracción muscular. Las sarcómeras contienen filamentos finos y filamentos gruesos. Los filamentos finos están formados sobre todo por una doble hélice con dos moléculas de actina (proteína sin actividad enzimática). Otras proteínas de los filamentos finos son la tropomiosina y la troponina. Los filamentos gruesos están formados principalmente por miosina, proteína de gran peso molecular que tiene una parte alargada y otra parte globular, con actividad ATP asa, que interacciona con la actina. En el músculo relajado, la tropomiosina impide la interacción entre la actina y la miosina.
En el microscopio, alternan bandas oscuras (A) y bandas claras (I). En las bandas A hay filamentos finos y filamentos gruesos; en las bandas I, sólo hay filamentos finos. En el centro de cada banda I hay una línea oscura (línea Z), punto de unión entre los filamentos finos de una sarcómera con los de la sarcómera adyacente. Cada sarcómera está delimitada por dos líneas Z. En el centro de la banda A hay una línea (línea M), hacia donde están orientadas las partes globulares de la miosina.
Durante la contracción, la longitud de los filamentos no varía sino que se producen interacciones entre los filamentos de miosina y los de actina, de tal forma que los de actina se deslizan hacia el centro de la banda A. Por lo tanto, durante la contracción la banda A no varía de longitud, mientras que la banda I se acorta y las líneas Z se aproximan entre sí, acortándose por lo tanto las sarcómeras.
La membrana de la célula muscular o sarcolema, tiene unas invaginaciones hacia el citosol denominadas túbulos transversales o “sistema T”, muy relacionadas con el retículo sarcoplásmico. Así, cuando tiene lugar una despolarización de la membrana, se produce la apertura de los canales de calcio del sistema T, y la entrada de calcio al citosol (fase 2), produce a su vez la salida masiva de calcio desde el retículo sarcoplásmico.
El calcio es un mensajero fundamental en la contracción cardíaca: una vez en el citoplasma, se une a la troponina C e induce un
cambio en su conformación, de tal forma que la tropomiosina deja de impedir la interacción entre la actina y la miosina, se desplaza
la actina hacia el centro de la banda A y así la sarcómera se acorta y el músculo se acorta y se contrae. En cada contracción, la actina y
la miosina interaccionan y se disocian muchas veces.
La hidrólisis del ATP se emplea realmente para posibilitar la disociación de la actina y la miosina en la relajación muscular (MIR 98-99F,223), y no en el golpe de remo de la contracción, que tiene lugar cuando la miosina libera el ADP En la repolarización, el retículo sarcoplásmico vuelve a capturar el calcio, por un mecanismo que de nuevo consume energía (ATP); así, el calcio se separa de la troponina C y la tropomiosina vuelve a impedir la interacción actina-miosina.
Todos los tipos de fibras musculares tienen una estructura contráctil básica de actina y miosina, si bien donde la interacción entre los miofilamentos se produce de una manera más organizada para dar lugar a contracciones más intensas, rápidas y mantenidas, es en el músculo estriado. En el músculo liso, el ciclo de unión y liberación de actina y miosina es más largo, pero consume menos ATP y da lugar a una contracción muscular de mayor duración que la del músculo estriado (MIR 03-04, 160).
Mecanismos de la contracción cardíaca
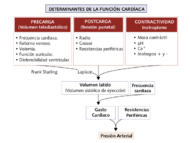
La tensión desarrollada por una fibra muscular al contraerse está en relación directa con la longitud inicial de la fibra, hasta llegar a un límite a partir del cual aumentos de la longitud inicial de la fibra no conseguirán aumentar la fuerza contráctil de la misma, sino disminuirla. Esta relación longitud-tensión es la ley de Frank-Starling.
De otra forma, está relaciona la precarga (volumen telediastólico del que depende la longitud de la fibra pues cuanto más “lleno” más “estiradas” están las fibras) con el volumen sistólico de eyección (MIR 97-98F, 168). Para una determinada longitud inicial de la fibra, el calcio, las catecolaminas y los fármacos inotrópicos aumentan la contractilidad miocárdica, y por lo tanto modifican la posición de las curvas longitud-tensión.
El volumen sistólico de eyección del VI por lo tanto depende de:
- Precarga o longitud del músculo al comienzo de la contracción,
- Capacidad contráctil de corazón (contractilidad), 3) postcarga o tensión que el músculo tiene que desarrollar durante la contracción.
La relación es directa con los dos primeros factores, e inversa con la postcarga.
- La precarga equivale al volumen telediastólico del ventrículo, y está directamente relacionado con la volemia total, el retorno venoso al corazón y la contracción auricular. El retorno venoso disminuye con el aumento de la presión intratorácica (Valsalva) e intrapericárdica o la bipedestación y aumenta con el decúbito, con la actividad muscular (MIR 97-98F, 165) y con el aumento del tono venoso (ejercicio muscular, inspiración profunda, etc.).
La contribución de la aurícula al llenado ventricular supone un 15-20% del llenado total en condiciones fisiológicas, y disminuye ante la pérdida de la capacidad contráctil de la aurícula (miocardiopatías, fibrilación auricular...) o la pérdida de la sincronía aurículoventricular (disociación AV, taquicardia intranodal...)
- La contractilidad miocárdica (inotropismo) aumenta con el empleo de digitálicos, catecolaminas y simpaticomiméticos, teofilinas, calcio, cafeína, etc. y a veces tras las extrasístoles ventriculares. Por el contrario, se encuentra disminuida cuando hay hipoxia, hipercapnia, acidosis o el empleo de fármacos inotrópicos negativos (antagonistas del calcio, betabloqueantes, antiarrítmicos, barbitúricos, alcohol, etc.) y en enfermedades miocárdicas.
- La postcarga cardíaca equivale a la tensión de la pared ventricular durante la sístole. Según la ley de Laplace (MIR 99-00F, 224), la tensión parietal es directamente proporcional a la presión intraventricular y al radio de la cavidad, e inversamente al grosor de la pared. La presión intraventricular izquierda está en relación directa con la presión aórtica y las resistencias arteriales periféricas. El VI ha de vencer la presión aórtica para su eyección, mucho mayor que la de la arteria pulmonar, por lo que realiza un mayor trabajo que el VD (MIR 95-96F, 93).
La fracción de eyección (FE) es el porcentaje de volumen que el VI consigue bombear del total que contiene justo antes de la contracción, es decir, al final de la diástole. En condiciones normales debe encontrarse entre 60-75%.
El gasto cardíaco (GC) o volumen minuto cardíaco es el volumen de sangre que el VI bombea en un minuto, y es igual al volumen sistólico del VI multiplicado por la frecuencia cardíaca (unos 5 l/min en adultos sanos) (MIR 99-00F, 221; MIR 96-97F, 238).
GC=VS x FC
El índice cardíaco es el gasto cardíaco por cada m2 de superficie corporal (para hacerlo estándar e independiente del tamaño del individuo), y sus valores normales se encuentran entre 2,5 y 3,5 l/min/m2.
La presión arterial (PA) depende del producto del GC por las resistencias periféricas:
PA = GC x RVP → GC = PA / RVP
De esta fórmula se deduce que el flujo sanguíneo a través de los vasos (GC) depende tanto de las cifras de tensión arterial como del grado de vasodilatación arterial. La presión arterial aumenta al incrementarse las resistencias vasculares periféricas. Sin embargo lo hace en mayor medida la PA diastólica (que depende más del tono vascular) que la PA sistólica (que lo hace más de la eyección cardiaca), por lo que disminuye la presión diferencial (MIR 96-97F, 226); por ejemplo un estímulo simpático intenso puede contraer tanto los vasos que el flujo sanguíneo se reduzca hasta casi cero durante períodos cortos, a pesar de una presión arterial elevada.
Ciclo cardíaco.
La sístole cardíaca es el período del ciclo cardíaco en el que el ventrículo se contrae, por tanto ocurre desde que se cierran las válvulas aurículoventriculares (primer tono cardíaco) hasta que lo hacen las sigmoideas (segundo tono); durante este período tiene lugar la eyección ventricular. Desde que se cierran las válvulas aurículoventriculares hasta que se abren las sigmoideas, el volumen de sangre intraventricular no varía (período de contracción isovolumétrica) (MIR 96-97F, 234). Cuando la presión intraventricular supera la presión de la aorta y la arteria pulmonar, se abren respectivamente las válvulas aórtica y pulmonar y comienza el período de eyección ventricular, que en principio es muy rápida y luego algo más lenta.
En condiciones normales, la válvula aórtica se abre después y se cierra antes que la pulmonar. La diástole ventricular es el periodo de relajación durante el cual tiene lugar el llenado ventricular. Cuando la presión en la aorta y en la arteria pulmonar supera la intraventricular (pues los ventrículos se relajan y disminuye la presión en su interior), se cierran las válvulas aórtica y pulmonar respectivamente. Desde que se cierran las válvulas sigmoideas hasta que se abren las aurículoventriculares, el volumen de sangre de los ventrículos no varía (período de relajación isovolumétrica). Cuando la presión intraventricular se hace inferior a la auricular, se abre la válvula aurículoventricular correspondiente, y comienza el llenado ventricular: una primera fase de llenado rápido, seguido por una fase de llenado lento (diastasis), y al final se produce la sístole auricular que produce el llenado de la contracción auricular, ausente en la fibrilación auricular.
Cuando aumenta la frecuencia cardíaca, disminuye mucho más el tiempo de diástole que el de sístole, por lo que las enfermedades con disminución de la distensibilidad o compliance ventricular toleran peor las taquicardias.
Presión arterial.
La función de las arterias estriba en transportar sangre a presión a los tejidos. Las arteriolas son las ramas más pequeñas del sistema arterial con una capa muscular contráctil en su pared que permite su contracción o relajación, actuando así como válvulas de control (MIR 94-95, 103). La presión arterial tiene un máximo (sistólica) y un mínimo (diastólica) a lo largo del ciclo cardíaco. La presión arterial media (presión del pulso) refleja mejor la presión de perfusión tisular que la sistólica o diastólica aisladas. En adultos jóvenes y sanos está entre 90 y 100 mmHg. Como la mayor parte del ciclo cardíaco en ausencia de taquicardia es diastólica, se calcula así:
PA media = ( PA sistólica + 2 x PA diastólica) / 3
En el adulto se denomina hipotensión a la existencia de una presión arterial media menor de 60 mmHg, una sistólica menor de 90 mmHg o un descenso de más de 40 mmHg sobre la basal, y se considera hipertensión (HTA) a cifras por encima de 140/90 mmHg (sistólica/diastólica). Recientemente se tienden a considerar como normales cifras de PA inferiores a 120/80 mmHg, y a los valores comprendidos entre 120-140/80-90 mmHg se les denomina prehipertensión arterial por la alta incidencia de desarrollo de HTA en el seguimiento de los pacientes con esas cifras.
La medida de la PA con el esfigmomanómetro se realiza desinflando lentamente el manguito y auscultando los ruidos de Korotkoff (ruidos producidos por la turbulencia de la sangre al atravesar el vaso constreñido). La PA sistólica corresponde a la fase I de Korotkoff (cuando empieza a oírse el latido), y la diastólica a la fase V (cuando dejan de oírse) salvo el la insuficiencia aórtica grave en que generalmente se emplea la fase IV (cuando se amortigua el ruido).
Regulación de la presión arterial
El control de la presión arterial es crucial para el buen funcionamiento de los órganos y sistemas, por lo que para su regulación existen varios mecanismos de entre los que el riñón es el de mayor relevancia. Regulación rápida de la tensión arterial. Se realiza por el sistema nervioso.
- Los barorreceptores aórticos y los carotídeos detectan el aumento de la presión y, a través de los nervios vago y de Hering (rama del glosofaríngeo) respectivamente, conducen los impulsos al tronco del encéfalo. El aumento de tensión arterial produce la inhibición del centro vasoconstrictor y la estimulación del centro vagal, por lo que se induce bradicardia y caída de la tensión arterial para su regulación (MIR 03-04, 163; MIR 96-97, 49).
- Los quimiorreceptores carotídeos son sensibles a la falta de oxígeno sanguíneo (hipoxemia). Cuando se produce una caída de la tensión por debajo de un nivel crítico, los quimiorreceptores se activan a causa de la disminución de flujo a los cuerpos carotídeos.
Se transmite una señal a través de fibras que acompañan a los barorreceptores hacia el tronco, activando el centro vasomotor y aumentando la tensión arterial mediante un aumento de la actividad simpática.
- Existen otros receptores de baja presión en las aurículas y arterias pulmonares que detectan los cambios de volumen sanguíneo y actúan en consecuencia sobre la tensión arterial.
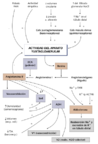
Regulación a largo plazo de la tensión arterial. Se realiza fundamentalmente por el riñón, mediante el sistema renina-angiotensina-aldosterona. Este es un sistema combinado, íntimamente relacionado con el control de la volemia y con la secreción de vasopresina.
Fisiología del eje renina-angiotensina- aldosterona
La renina es una enzima producida y almacenada en los gránulos de las células yuxtaglomerulares, actúa sobre el angiotensinógeno (globulina sintetizada en el hígado), transformándolo en angiotensina I. Esta es transformada por la enzima de conversión, presente en múltiples tejidos, especialmente en el endotelio vascular del pulmón, en angiotensina II, que estimula la síntesis de aldosterona en la zona glomerular de la corteza suprarrenal e induce vasoconstricción.
La liberación de renina está controlada por cinco factores:
- Estímulos de presión, vehiculados por las células yuxtaglomerulares. La disminución de la presión de perfusión renal estimula la síntesis de renina; es el factor más importante.
- Quimiorreceptores de la mácula densa, son células íntimamente relacionadas con las células yuxtaglomerulares y controlan la sobrecarga de sodio o cloro presentada al túbulo distal. Si la cantidad de sodio filtrada aumenta, aumenta la liberación de renina.
- Sistema nervioso simpático, estimula la liberación de renina en respuesta a la bipedestación.
- Potasio, el aumento de potasio disminuye directamente la liberación de renina y viceversa.
- La angiotensina II ejerce una retroalimentación negativa sobre la liberación de renina.
La angiotensina II influye en la homeostasis del sodio. Sus acciones se ejercen a través de sus receptores tipo 1 y 2. Entre ellas destaca: aumento de la reabsorción de sal en el túbulo proximal, contracción de las arteriolas aferente y en mayor medida eferente renales favoreciendo la reabsorción renal de sodio, estimula la liberación de aldosterona, estimula el centro de la sed y parece que también la síntesis y liberación de ADH. También produce vasoconstricción.
Vasopresina. El aumento de la osmolaridad, la disminución de volumen y la disminución de la tensión arterial son capaces de estimular la secreción de vasopresina (ADH u hormona antidiurética), que posee efectos vasoconstrictores directos (actuando en los receptores V1) y aumenta la reabsorción de agua en el túbulo colector renal (receptores V2).
La aldosterona realiza dos acciones fundamentalmente: actúa como regulador del volumen del líquido extracelular y controla el metabolismo del potasio. El volumen se regula por la acción directa de la aldosterona sobre el transporte renal tubular de sodio; actúa sobre el túbulo contorneado distal aumentando la reabsorción de sodio y aumentando la eliminación de potasio (y de hidrogeniones H+) en la orina. Los mecanismos primarios de control de la aldosterona son tres: el sistema renina-angiotensina (estimulación, el más importante), el potasio plasmático (estimulación) y la ACTH (estimulación, importancia secundaria). La sobrecarga de sodio, el péptido atrial natriurético y la dopamina inhiben la secreción de aldosterona. Cuando se realiza una infusión intravenosa de aldosterona se produce un aumento de la reabsorción renal de sodio que desaparece en 3-5 días. A esto se le denomina fenómeno de escape y explica que en el hiperaldosteronismo primario no existan edemas.
Se ha implicado un aumento del péptido atrial natriurético en la génesis de este fenómeno. El potasio y los hidrogeniones no sufren este mecanismo de escape por lo que tienden a acumularse en esa enfermedad.
Conviene destacar que el estímulo del eje renina-angiotensina aldosterona además de los efectos hidroelectrolíticos y vasoconstrictores citados, a largo plazo facilita el desarrollo de fibrosis intercelular a niveles fundamentalmente vascular y cardiaco.
Adaptabilidad al ejercicio
En reposo, el 40% del volumen sanguíneo se encuentra en pequeñas venas de la circulación sistémica (MIR 99-00F, 222). Durante el ejercicio el sistema respiratorio se adapta para aumentar la captación de oxígeno. La capacidad máxima de ejercicio viene determinada por el aporte de oxígeno a los tejidos y por el grado de adecuación intrínseca del sistema musculoesquelético. Durante la realización de ejercicio, los tejidos llegan a necesitar hasta 400 ó 500 veces la cantidad de oxígeno que utilizan en reposo. Este aumento se logra gracias a diferentes medidas de adaptación (MIR 95-96F, 205): a. Aumento del gasto cardíaco mediado por un aumento de la frecuencia cardíaca y del volumen sistólico. Esto produce un incremento de las cifras de la PA (de la sistólica, ya que la diastólica casi no se modifica en individuos normales). El gasto cardíaco puede llegar desde los 4-5l/min hasta 30-35 l/min. b. Aumento de la cantidad de oxígeno que llega a los pulmones mediante un aumento de la ventilación minuto. Se puede pasar de 6-8 l/min a 100 l/min. c. Incremento del oxígeno que llega a las células musculares: esto es debido a la vasodilatación local (lo cual explica que no se incrementen las cifras de PA por disminución de las resistencias periféricas) y al aumento de la extracción de oxígeno debido a cambios en la curva de disociación de la hemoglobina, que durante el ejercicio se desplaza a la derecha. d. Aumento de la cantidad de sangre dirigida hacia la piel. Esto redunda en una mayor capacidad para disipar la energía que se transforma en calor durante el ejercicio físico.
Una de las razones más importantes por la que un deportista aumenta la capacidad de ejercicio es por el incremento en la capacidad para utilizar el metabolismo aerobio hasta etapas más tardías, lo cual frena la producción de lactato y la acidosis tisular. Asimismo, en el entrenamiento se produce hipertrofia del músculo cardíaco, que facilita la consecución de gastos cardíacos mayores durante el ejercicio y permite que en reposo pueden mantenerse gastos cardíacos normales con frecuencia cardiaca más baja (MIR 99-00F, 47).
Es conveniente matizar que una contracción muscular tónica sostenida (ejercicio isométrico: levantar pesas...), sobre todo de un pequeño grupo muscular, produce un efecto predominantemente vasoconstrictor simpático, aumentando la presión arterial de forma severa. En el ejercicio isotónico, sin embargo (natación...), predomina el efecto vasodilatador de la acción muscular generalizada no intensa.
Fuentes
- Cardiología y Cirugía Cardiovascular/ Colectivo de autores. T3. La Habana: Editorial Ciencias Médicas; 2006.
- Anatomía y Fisiología clínica del sistema cardiovascular
- Folleto de fisilogía