Coagulación de la sangre
| ||||||
La hemostasia (coagulación de la sangre) es el resultado de una serie de procesos perfectamente regulados que cumplen dos funciones importantes:
- mantener la sangre en estado líquido y sin coágulos dentro de los vasos sanguíneos normales, y
- estar preparado para formar rápidamente un tapón hemostático localizado en el punto de lesión vascular.
Sumario
Proceso
Cuando una lesión afecta la integridad de las paredes de los vasos sanguíneos, se ponen en marcha una serie de mecanismos que tienden a limitar la pérdida de sangre. Estos mecanismos llamados de hemostasia comprenden la vasoconstricción local del vaso, el depósito y agregación de plaquetas y la coagulación de la sangre.
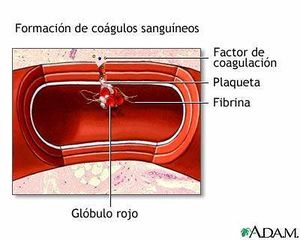
Se denomina coagulación al proceso, por el cual, la sangre pierde su liquidez, tornándose similar a un gel en primera instancia y luego sólida, sin experimentar un verdadero cambio de estado.
Este proceso es debido, en última instancia, a que una proteína soluble que normalmente se encuentra en la sangre, el fibrinógeno, experimenta un cambio químico que la convierte en insoluble y con la capacidad de entrelazarse con otras moléculas iguales, para formar enormes agregados macromoléculares en forma de una red tridimensional.
El fibrinógeno, una vez transformado, recibe el nombre de fibrina. Coagulación es por lo tanto, el proceso enzimático por el cual el fibrinógeno soluble se convierte en fibrina insoluble, capaz de polimerizar y entrecruzarse.
Un coágulo es, por lo tanto, una red tridimensional de fibrina que eventualmente ha atrapado entre sus fibras a otras proteínas, agua, sales y hasta células sanguíneas.
Por una convención se denomina trombo a un coágulo formado en el interior de un vaso sanguíneo.
Factores
El proceso de coagulación implica toda una serie de reacciones enzimáticas encadenadas de tal forma que actúan como un alud o avalancha, amplificándose en cada paso: un par de moléculas iniciadoras activan un número algo mayor de otras moléculas, las que a su vez activan un número aún mayor de otras moléculas, etc.
En esta serie de reacciones intervienen más de 12 proteínas, iones de Ca2+ y algunos fosfolípidos de membranas celulares.
A cada uno de estos compuestos participantes en la cascada de coagulación se les denomina «factor» y comúnmente se lo designa por un número romano elegido de acuerdo al orden en que fueron descubiertos.
Siete de los factores de coagulación (precalicreína —factor V—, protrombina —Factor II—, proconvertina —factor VII—, factor antihemofílico beta —IX—, factor Stuart —X—, tromboplastina plasmática —XI— y factor Hageman —XII—) son zimógenos sintetizados en el hígado, esto es, proenzimas que normalmente no tienen una actividad catalítica importante, pero que pueden convertirse en enzimas activas cuando se hidrolizan determinadas uniones peptídicas de sus moléculas.
Estas proenzimas, una vez recortadas, se convierten en proteasas de la familia de las serina proteasas; capaces de activar a las siguientes enzimas de la cascada.
Una enzima activa recorta una porción de la siguiente proteína inactiva de la cascada, activándola.
Algunos factores de coagulación requieren vitamina K para su síntesis en el hígado, entre ellos los factores II (protrombina), VII (proconvertina), IX (antihemofílico beta) y X (Stuart).
Espasmo vascular
Después de la lesión inicial, se produce el espasmo vascular o sea una vasoconstricción arteriolar de breve duración, que en gran parte se atribuye a mecanismos neurógenos reflejos y que se acentúa con la secreción local de ciertos factores, como la endotelina, un potente vasoconstrictor derivado del endotelio y el tromboxano (TxA2) sintetizado por las plaquetas, el cual es un importante vasoconstrictor local.
La constricción de una arteriola o arteria pequeña lesionada puede ser tan notable que se oblitere su luz. Sin embargo las paredes arteriales seccionadas longitudinalmente o de manera irregular, no se contraen de modo que la luz de la arteria se ocluya y la hemorragia continúa.
Hemostasia primaria
Las plaquetas se adhieren a la matriz extracelular expuesta mediante el factor de von Willebrand (vWF), y se activan, cambiando de forma y liberando sus granulaciones; el difosfato de adenosina (ADP) y el tromboxano A2 (TxA2) liberados, ponen en marcha una reacción autocatalítica, que conduce a la formación de un agregado creciente de plaquetas: el tapón hemostático primario, es decir, la lesión del endotelio deja al descubierto la matriz extracelular subendotelial (MEC), de intenso poder trombógeno, que permite a las plaquetas adherirse y activarse, es decir, sufrir un cambio de forma y vaciar sus granulaciones secretorias.
En pocos minutos, los productos secretados atraen a otras plaquetas y se forma el tapón hemostático; éste es el proceso de la hemostasia primaria. A partir de este momento se inicia el proceso de la coagulación.
Etapas de la coagulación
El proceso de la coagulación tiene tres etapas:
- La formación del activador de protrombina.
- Conversión de protrombina en trombina.
- Conversión de fibrinógeno en fibrina.
Activador de protrombina
Puede formarse por dos vías una extrínseca y otra intrínseca.
- Extrínseca, es más rápida, se inicia con la lesión de la pared del vaso o de los tejidos vecinos, liberándose el factor tisular o tromboplastina tisular que inicia una serie de reacciones enzimáticas hasta formar el activador de protrombina. * Intrínseca, es más lenta, se inicia con el traumatismo de la propia sangre o con la exposición de la sangre al colágeno de un vaso lesionado. El traumatismo sanguíneo provoca la activación del factor XII y la liberación de fosfolípidos plaquetarios, a partir de aquí se inicia la cascada enzimática que culmina con la formación del activador de protrombina.
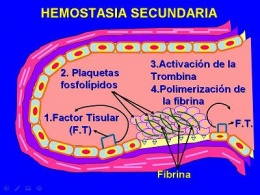
Hemostasia secundaria
El factor tisular, que es un factor procoagulante unido a la membrana y sintetizado por el endotelio, también queda al descubierto en el sitio de la lesión. Este factor actúa junto a los factores secretados por las plaquetas para activar la cascada de la coagulación, y culmina con la activación de la trombina.
La trombina, a su vez, convierte al fibrinógeno en fibrina insoluble, que acaba depositándose localmente. También produce un nuevo reclutamiento de plaquetas y la liberación de sus granulaciones. Esta serie de fenómenos, denominados hemostasia secundaria, dura más tiempo que la formación del tapón plaquetario.
La activación local de la cascada de la coagulación, donde participan el factor tisular y los fosfolípidos plaquetarios, da lugar a la polimerización de la fibrina, que aglutina o cimenta a las plaquetas en un tapón hemostático secundario definitivo.
Retracción del coágulo
Pocos minutos después de formarse el coágulo empieza a contraerse y suele exprimir la mayor parte del líquido de su interior, el que se denomina suero, este no tiene fibrinógeno ni otros factores de la coagulación por lo cual no coagula, a esto se denomina retracción del coágulo.
La trombina y los iones de calcio liberados por las plaquetas activan o aceleran la contracción, esto favorece la unión de los bordes del vaso lesionado contribuyendo a la hemostasia final.
Posteriormente el coágulo puede ser invadido por fibroblastos que sintetizan tejido conectivo, favorecido por el factor de crecimiento liberado por las plaquetas con lo cual se organiza de manera fibrosa o puede disolverse a través del proceso de fibrinolisis.
Prevención de la coagulación
Entre los factores que evitan la coagulación en el sistema vascular normal se encuentran: Los de la superficie endotelial, dentro de este:
- La lisura de la superficie endotelial evita la activación por contacto del sistema intrínseco de la coagulación.
- Capa de glucocálix, mucopolisacárido adsorbido a la superficie del endotelio, que repele los factores de la coagulación y las plaquetas impidiendo que se active la coagulación.
Por otra parte no se activa la trombomodulina, proteína que se une a la trombina e impide que esta participe en la coagulación, además el complejo trombomodulina-trombina, activa una proteína plasmática, llamada proteína C que actúa como anticoagulante al inactivar los factores V y VIII activados.
Anticoagulantes
Un anticoagulante es, como su nombre lo indica, una sustancia química que retrasa o impide la coagulación de la sangre, ya sea en el interior de un organismo (in vivo) o en el exterior (in vitro).
Existen diferentes tipos de anticoagulantes que actúan dificultando o impidiendo alguno de los pasos de la cascada de coagulación.
Existen dos tipos principales de anticoagulantes, los anticoagulantes para uso in vitro y los que tienen empleo in vivo, entre estos últimos se encuentran los medicamentos con acción anticoagulante.
En general los anticoagulantes para uso in vitro actúan como quelantes del ion Ca2+, de manera tal que este no puede participar en la formación de los complejos que activan al factor X, y por lo tanto se interrumpe la cascada de coagulación casi en su inicio.
Los anticoagulantes para uso in vivo actúan de maneras un poco más complicadas. La adición de algunos agentes quelantes tales como el EDTA entrañan un grave riesgo para la salud del individuo sometido a tratamiento, ya que estos agentes son capaces de acomplejar gran cantidad de iones con alta afinidad, algunos de los cuales desempeñan importantes funciones en el organismo tales como el Cu2+, Fe3+, Zn2+, etc; mientras que otros agentes acomplejantes del calcio tales como el citrato, no tienen gran utilidad ya que son rápidamente metabolizados perdiendo su capacidad anticoagulante.
Entre los anticoagulantes para uso in vivo encontramos sustancias tales como la heparina o los anticoagulantes dicumarínicos.
Sustancias de acción antitrombínica
Entre las sustancias que tienen acción antitrombínica se encuentran
- Los filamentos de fibrina que adsorben la mayor parte de la trombina producida durante la formación del coágulo, suprimiendo la trombina de la sangre.
- La trombina no adsorbida a la fibrina se combina con rapidez con la antitrombina III o cofactor antitrombina-heparina, bloqueando la acción de la trombina sobre el fibrinógeno y por consiguiente la formación del coágulo.
Clasificación
Tradicionalmente la coagulación sanguínea se ha dividido en dos vías, la extrínseca e intrínseca, las cuales convergen en una vía final común para la formación de trombina.
El término extrínseca implica que una sustancia extravascular es necesaria para iniciar la coagulación sanguínea y la intrínseca indica que todos los componentes están en el sistema vascular; el mecanismo preciso por el cual se inicia la coagulación sanguínea continúa causando gran debate. Muchas de las reacciones que son descritas ocurren en la superficie de membranas de las plaquetas agrupadas.
En la vía extrínseca la teoría más acertada es el contacto de la sangre con una lipoproteína (tromboplastina tisular, factor tisular), la cual se encuentra en los tejidos y forma un complejo con el factor VII (proconvertina), llevando a la activación enzimática el factor VII-a, que unido al factor tisular actúa sobre el factor X, dando lugar a otra enzima proteolítica, la cual forma un complejo con el factor V, calcio y fosfolípidos.
La activación del factor X y la formación del complejo Xa – Ca - fosfolípido – factor V, lo cual parece ocurrir en la membrana plaquetaria, convierte la protombina, por una serie de rupturas proteolíticas, en una enzima activa, la trombina.
La iniciación de la coagulación sanguínea por la vía intrínseca es compleja. Cuando la sangre se pone en contacto con una superficie anormal (vidrio, superficie de cargas negativas, endotelio anormal, colágeno o componentes sub-endoteliales), el factor XII (factor Hageman) se adhiere y activa en el sitio de exposición. Simultáneamente la prekalicreina (factor Fletdier), factor XI y el Kininógeno de alto peso molecular (factor Fitzgerald) se unen a la superficie anormal o dañada y forman un complejo localizado de superficie. El factor Fitzgerald sirve como cofactor de superficie para reunir la prekalicrina o factor XI en la proximidad de la superficie de unión con el factor XII.
Recíprocamente la activación proteolítica entre el factor XII y la prekalicreina puede ser la primera reacción en la vía intrínseca. El factor Hageman puede activarse en ausencia del factor Fletcher o del Fitzgerald, pero es de 50 a 100 veces más lento. Una vez activado, el factor XII-a convierte el complejo factor XI-kininógeno de alto peso molecular a factor XIa.
Las vías extrínsecas e intrínsecas están probablemente relacionadas en algunos puntos; el factor XIIa puede también activar el factor VII, considerando en el pasado su única vía de activación por el sistema extrínseco. En conclusión, las relaciones iniciales que constituyen la fase de contacto de la coagulación pueden ser resumidas a continuación:
- 1. El factor Hageman unido a la superficie de exposición se activa y convierte la prekalicreina plasmática en kalicreína.
- 2. La kalicreína por rupturas proteolíticas convierte el factor Hageman en forma de zimógeno en factor Hageman activado.
- 3. La ruptura del Kininógeno de alto peso molecular por la kalicreína produce el péptido bradikinina, el cual tiene la propiedad de dilatar los vasos sanguíneos, contraer la musculatura lisa, producir dolor y promover la migración leucocitaria.
- 4. El factor XIIa puede activar el factor VII.
- 5. El factor XIIa bajo ciertas condiciones puede convertir el plasminógeno a plasmina.
Una vez generado el factor XIa, convierte el factor IX, en presencia de calcio, en factor IXa. Como ocurre con otros factores dependientes de la vitamina K, los fosfolípidos no son requeridos para la generación del factor IXa.
Otro ejemplo de la interacción entre las vías extrínsecas e intrínsecas es la observación que el complejo factor VII-tromboplastina tisular-Ca puede activar directamente el factor IX, independientemente del factor XIa.
La interacción del factor IXa con el factor IXa con el factor VIII no es clara hasta el momento. La teoría más acertada es que el factor IX activado unido al factor VIII, fosfolípido y calcio iónico, forman un complejo que convierte el factor X en factor Xa.
Las características estructurales y funcionales del factor VIII permanecen en discusión. Se acepta que circula como un complejo proteína el cual requiere de una ruptura enzimática para desarrollar su actividad procoagulante que interacciona con el factor IXa, Ca y fosfolípido para formar el factor Xa. El factor VIIIa también posee una actividad no afectada por la trombina (actividad de Von Willebrand) que es importante en la función plaquetaria. Estas dos actividades del factor VIII, la procoagulante y de adhesión plaquetaria, están íntimamente asociadas in vivo y pueden ser separadas in vitro bajo condiciones físico-químicas no usuales. Estos hechos hacen pensar que el factor VIII circula unido con el factor de Von Willebrand, formando un complejo.
La vía común de la coagulación sanguínea en la cual convergen la vía extrínseca e intrínseca comienza con la generación del factor Xa y por una serie de pasos lleva a la producción de trombina. La trombina es una enzima que puede participar en varias reacciones de la coagulación:
- 1. Se une a las plaquetas y promueve la liberación de ciertos componentes plaquetarios, ej: el ADP que causa agregación plaquetaria.
- 2. Activa la fosfolipasa C de la membrana plaquetaria, la cual inicia la síntesis de prostaglandinas para generar tromboxano A2, que estimula la agregación plaquetaria.
- 3. Tiene un efecto proteolítico sobre los factores V y VIII y puede ser requisito para la actividad manifiesta procoagulante de los factores V y VIII.
- 4. La trombina, por ruptura proteolítica del fibrinógeno, inicia su conversación en fibrina.
- 5. Activa el factor XIII por ruptura proteolítica.
Fibrinólisis
La fibrinólisis es un sistema enzimático que elimina el coágulo y restaura el flujo de sangre en un vaso lesionado. Es mediado por la enzima plasmina, una endopeptidasa relativamente inespecífica, capaz de separar una gran cantidad de proteínas, tales como el fibrinógeno, la fibrina, los factores V y VIII, los componentes del complemento, la ACTH y la hormona del crecimiento, cada una de las cuales contiene enlaces de ariginina y lisina. Debido a que la actividad de la plasmina es relativamente inespecífica, circula en la forma inactiva de plasminógeno; además, el plasminógeno tiene una gran afinidad para unirse a la fibrina al polimerizarse para formar el coágulo, por consiguiente, cuando tiene lugar la coagulación, el plasminógeno se une al coágulo de fibrina y se transforma en su forma activa, la plasmina.
El plasminógeno ligado a la fibrina se activa mediante los activadores tisulares que se encuentran en las células endoteliales y en otros tejidos.
Existen otras proteínas plasmáticas que sirven como potentes inhibidores de ciertas enzimas de la coagulación. Estos inhibidores son: alfa - 2 macro globulina, alfa – 2 antiplasmina, antitrombina III, alfa – 1 antitripsina y el C1 inactivador.
De estos, los primeros tres mencionados tienen mayor importancia en el sistema de la coagulación. Normalmente estos inhibidores pueden modular la actividad de ciertas proteasasde la coagulación sanguínea. La alfa 2 macroglobulina suprime la mayoría si no toda la actividad de la trombina y plasmina; la alfa – 2 antiplasmina III es un inhibidor de la plasmina y la antitrombina III es un inhibidor efectivo del factor Xa y la trombina, puede bloquear la actividad de otros factores de la coagulación excepto el factor VII, de aquí su importancia en la prevención de la trombosis. La heparina potencia la acción de la antitrombina III y está en presencia de la heparina, puede inhibir el factor VIIa. Estos inhibidores plasmáticos unidos a las proteasas forman complejos que son aclarados rápidamente en el hígado y sistema reticuloendotelial.
Interpretación clínica de las diferentes pruebas de la coagulación
Tiempo de sangramiento: se encuentra prolongado en trastornos vasculares y plaquetarios, cuantitativos o cualitativos.
Retracción del coágulo: se altera en estados trombocitopénicos y trastornos de la función plaquetaria.
Conteo de plaquetas: sirve para detectar una trombocitopenia.
Las alteraciones tanto en la vía intrínseca como extrínsecas se manifiestan por la prolongación en los tiempos de protombina o parcial de tromboplastina. Es importante recordar que existen limitaciones en estas pruebas, como por ejemplo, no miden el déficit del factor XIII y además su nivel de sensibilidad puede no detectar una ligera disminución en algunos de los factores de la coagulación.
Tiempo de protrombina: se prolonga cuando existen déficit de los factores II, V, VII y X. Si la concentración de fibrinógeno es inferior a 100 mg/dL o en presencia de los productos derivados de la heparina o fibrina /fibrinógeno.
Tiempo parcial de tromboplastina: esta prueba es sensible a la disminución en los factores V, VIII, IX, y XII o cuando los niveles de fibrinógeno son inferiores a 100 mg/dL o por el aumento de los productos de degradación del fibrinógeno, es de gran utilidad para el seguimiento de pacientes bajo terapéutica anticoagulante con heparina.
Tiempo de trombina: mide directamente la capacidad de la trombina para convertir el fibrinógeno en fibrina. Se prolonga cuando existe déficit o alteración molecular del fibrinógeno.
Una variante del tiempo de trombina es la que utiliza la enzima reptilasa, la cual actúa sobre el fibrinopéptido Adel fibrinógeno y cuya actividad enzimática no es inhibida por la heparina. Es de gran utilidad en la práctica médica para diferenciar un alargamiento en el tiempo de trombina debido a heparina, de un déficit de fibrinógeno o una disfibrinogenemia.
Productos de degradación del fibrinógeno: se incrementan en el curso de una coagulación intravascular diseminada, en enfermedades hepáticas graves, alteraciones del mecanismo fibrinolítico o en procesos trombóticos, pueden inhibir la coagulación normal al interferir la polimerización de la fibrina y alterar la función plaquetaria.
Existen otras pruebas que miden el estado del sistema fibrinolíticos como son el tiempo de lisis de la euglobulina y el plasminógeno (que solo están disponibles en labotarios especializados de coagulación).
La presencia de una alteración en la coagulación en un individuo sano hace sospechar la posibilidad de un anticoagulante circulante. La mayoría de estos anticoagulantes circulantes son anticuerpos y pueden aparecer espontáneamente, con el uso de algunos medicamentos, en el posparto o asociados a enfermedades autoinmunes.
Fuente
- Ganong, William F. (2006): Fisiología médica 20.ª edición, en español, 2006.
- Kumar. Ch. (2009): «Haemodynamic diseases», Robbins y Cotran: Pathologic Basis of Disease Saunders (Elsevier): octava edición, 2009.
- Negrín Villavicencio, Dr. José A., y coautores principales: Texto para la especialización de enfermería en cuidados intensivos, tomo III. La Habana: Editorial Pueblo y Educación, 1990.
- "Hemostasia", artículo en el sitio web El Ergonomista.
- "Hemostasia", artículo en el sitio web Medmol.es.
- Coagulación (material gráfico), artículo en el sitio web Medmol.
- Coagulación - Foto, en el sitio web Medicina Preventiva.
- Cascada de la coagulación - Esquema, artículo en el sitio web D Farmacia.
- Europa
- Greenfacts
- Portales médicos
- Salud