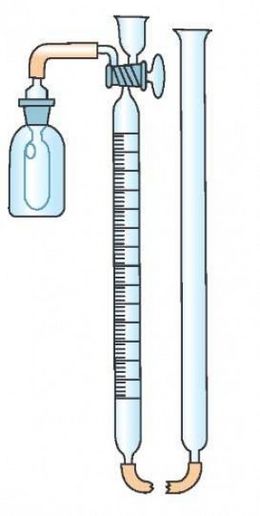
Nitrómetro
| ||||||
Nitrómetro . Instrumento utilizado para determinar la proporción de nitrógeno que contienen los nitratos y los éteres nítricos y que se funda en medir el volumen de óxido nítrico que los mismos desprenden al reaccionar con ácido sulfúrico. Este vocablo en su etimología, está compuesto del prefijo «nitro» del griego «νιτρο» (nitro) y del sufijo «metro» proveniente de «μετρον» (metron) que significa medida. También es conocido como azotometer.
Determinación de la presencia del nitrógeno
El nitrógeno se determina por diferentes métodos: el análisis Kjeldahl (método químico húmedo), el luminiscente o NIR (infrarrojo cercano) y el método de Dumas, además conocido como análisis de combustión, en el cual interviene el instrumento al cual se refiere este artículo. Este método se funda en el hecho de que cuando un compuesto orgánico que contiene nitrógeno se calienta fuertemente con óxido de cobre, se descompone en dióxido de carbono, agua, nitrógeno y sus óxidos. En este procedimiento una muestra pesada del compuesto a analizar, se mezcla con óxido de cobre en polvo y se calienta en un tubo a través del cual se pueda hacer pasar una corriente de dióxido de carbono puro. El extremo de salida del tubo está unido a una bureta para medir gases (nitrómetro), llena de una disolución concentrada de hidróxido potásico. El cuerpo del tubo va relleno de esponja de cobre y se calienta en un horno eléctrico, el cobre reduce el óxido de nitrógeno a nitrógeno molecular. El tubo se lava con una corriente de dióxido de carbono y los gases producidos se conducen al nitrómetro, donde el dióxido de carbono es absorbido y el nitrógeno se recoge. La cantidad de nitrógeno existente en la muestra se lee directamente como un volumen en la bureta calibrada y se pasa a condiciones normales de presión y temperatura en la forma acostumbrada. Ejemplo: 3.6 mg de un compuesto orgánico dieron 0.45 mililitros de nitrógeno (a O°C y 760 mm).
Este volumen de nitrógeno es igual a 0.45/22.4 x 28 = 0.56 mg:
% de N = 0.56/3.36 x 100 = 16.75
Utilidad
Aunque actualmente existen métodos más modernos y eficientes para la obtención del nitrógeno, este instrumento, por emplear pocos recursos, es práctico en condiciones de laboratorios para la enseñanza, especialmente de disciplinas como la química. El nitrógeno es uno de los átomos esenciales para la vida (vegetal, animal y humana), ya que forma parte de moléculas tales como el ADN, ARN (configuración genética hereditaria), vitaminas de grupo B, órganos, tejidos, hormonas, enzimas y anticuerpos, necesarias para poder vivir y desarrollar una salud sana y adecuada. Es por esto que es tan importante la determinación de nitrógeno en los suelos en donde se realizan los cultivos, en fertilizantes y en los alimentos que ingerimos, ya que de esta forma podemos saber cuánto es en valor nutricional (proteínas) lo que absorbemos.
Fuentes
- Mingot,Tomás de Galiana. Pequeño Larousse de Ciencias y Técnicas. Pág.730