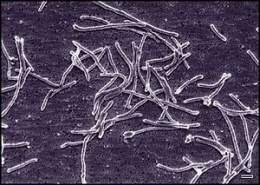
Thermus aquaticus
| ||||||||||||
Thermus aquaticus es una especie de bacteria que puede tolerar altas temperaturas, una de varias bacterias termófilas que pertenecen al grupo Deinococcus-Thermus. Es la fuente de la enzima resistente al calor Taq ADN polimerasa , una de las enzimas más importantes en la biología molecular debido a su uso en la reacción en cadena de la polimerasa (PCR), técnica de amplificación de ADN.
Sumario
Historia
Cuando los estudios de organismos biológicos en aguas termales se iniciaron en la década de 1960, los científicos pensaban que la vida de las bacterias termófilas no pudo mantenerse en temperaturas superiores a 55 ° Celsius (131 ° Fahrenheit). Sin embargo, pronto se descubrió que muchos bacterias en diferentes muelles no sólo sobrevivieron, sino también prosperaron en temperaturas más altas. En 1969, Thomas D. Brock y Hudson Freeze de la Universidad de Indiana informó de una nueva especie de termófilo bacteria que llamaron Thermus aquaticus. La bacteria fue descubierta por primera vez en el Lower Geyser Basin del Parque Nacional de Yellowstone , cerca de los grandes géiseres Gran Fuente Geyser y blanco de la bóveda del géiser , y desde entonces ha sido encontrado en hábitats térmicas similares en todo el mundo.
Biología
Se desarrolla a 70 ° C (158 ° F), pero puede sobrevivir a temperaturas de 50 ° C a 80 ° C (122 ° F a 176 ° F). Esta bacteria es un chemotroph, realiza quimiosíntesis para obtener alimentos. Sin embargo, ya que su gama de temperatura se superpone un poco con el de la fotosintética cianobacterias que comparten su entorno ideal, que se encuentra a veces viviendo conjuntamente con sus vecinos, la obtención de energía para el crecimiento de su fotosíntesis.
Morfología
Thermus aquaticus es generalmente de forma cilíndrica con un diámetro de 0,5 micras a 0,8 micras. La forma de varilla más corto tiene una longitud de 5 micras a 10 micras. La forma de filamento más largo tiene una longitud que varía en gran medida y, en algunos casos excede de 200 micras. Las bacterias en forma de bastón tienen una tendencia a agregarse. Asociaciones de varios individuos pueden conducir a la formación de cuerpos esféricos 10 micras a 20 micras de diámetro, también llamados cuerpos rotundas.
Las enzimas de T. aquaticus
De T. aquaticus se ha convertido en famoso como una fuente de enzimas termoestables, en particular el "Taq" ADN polimerasa, tal como se describe a continuación.
Aldolasa
Estudios de esta bacteria termófila extrema en cultivo celular se centraron inicialmente en intentos de comprender cómo la proteína enzimas (que normalmente no viven a altas temperaturas) pueden funcionar a altas temperaturas en los termófilos . En 1970, Freeze y Brock publicó un artículo describiendo un termoestable aldolasa enzima de T. aquaticus.
ARN polimerasa
La primera enzima polimerasa aislada a partir de T. aquaticus en 1974 era una ADN-polimerasa dependiente de ARN, utilizado en el proceso de la transcripción .
Enzima de restricción Taq I
La mayoría de los biólogos moleculares probablemente se dieron cuenta de T. aquaticus en la década de 1970 o principios de 1980 debido al aislamiento de útiles endonucleasas de restricción de este organismo. El uso del término "Taq" para referirse a T Hermo aquaticus surgió en este momento de la convención de dar las enzimas de restricción nombres cortos , tales como Sal y Hin, derivada del género y especies de los organismos fuente.
ADN polimerasa ("Taq Pol")
ADN polimerasa fue aislado de T. aquaticus en 1976. La primera ventaja encontrado para esta termoestable (temperatura óptima 80 ° C) ADN polimerasa era que podía ser aislado en una forma más pura (libre de otros contaminantes de la enzima) que podría la ADN polimerasa a partir de otras fuentes. Más tarde, Kary Mullis y otros investigadores de Cetus Corporation descubrieron esta enzima podría utilizarse en la reacción en cadena del proceso polimerasa (PCR) para la amplificación de segmentos cortos de ADN , la eliminación de la necesidad de añadir enzima después de cada ciclo de desnaturalización térmica del ADN . La enzima también fue clonado , secuenciada , modificada (para producir el fragmento Stoffel 'más corto), y se produce en grandes cantidades para su venta comercial. En 1989 una revista de Ciencias llama a Taq polimerasa como su primera "molécula del año". En 1993, el Dr. Mullis recibió el Premio Nobel por su trabajo con PCR.
Otras enzimas
La temperatura óptima para T. aquaticus permite a los investigadores estudiar las reacciones en las condiciones para las que otras enzimas pierden actividad. Otras enzimas aisladas a partir de este organismo incluyen la ADN ligasa , la fosfatasa alcalina , la NADH oxidasa , isocitrato deshidrogenasa , amylomaltase , y la fructosa 1,6-difosfato-dependiente de L-lactato deshidrogenasa .
Controversia
El uso comercial de enzimas a partir de T. aquaticus no ha estado exento de polémica. Después de los estudios del Dr. Brock, muestras del organismo fueron depositados en la Colección de Cultivos Tipo Americana , un repositorio público. Otros científicos, incluidos los de Cetus, obtenidos a partir de ahí. A medida que el potencial comercial de Taq polimerasa se hizo evidente en la década de 1990, el Servicio de Parques Nacionales etiquetada su uso como el "Gran Taq Rip-off". Los investigadores que trabajan en los parques nacionales están obligados a firmar "reparto de beneficios" acuerdos que enviarían una porción de los beneficios posteriores de nuevo al Servicio de Parques.