Linfocito T CD4+
Linfocitos T CD4+. La actividad de estas células es inusual, en tanto no son capaces de producir efectos Citotóxicos o Fagocitarios, es decir, no pueden aniquilar la célula huésped (también conocidas como Células somáticas) o Patógenos. Sin la ayuda de otras células inmunitarias se consideran inútiles contra una infección. Los linfocitos Th están involucrados en la activación y dirección de otras células inmunitarias, y son particularmente importantes en la respuesta inmune adaptativa. Son esenciales en el proceso de conmutación para la posterior formación de anticuerpos por parte de los linfocitos B, en la activación y crecimiento de los linfocitos T citotóxicos, y en el aumento de la actividad bactericida de fagocitos como los macrófagos. Es esta diversidad en su función y su papel en la influencia de otras células lo que les da a los linfocitos T "colaboradores" su nombre.
Sumario
Importancia
Se cree que los linfocitos Th maduros siempre expresan su proteína de superficie CD4. Los linfocitos T que expresan activamente su CD4 son entonces llamados linfocitos T CD4+. Se considera que estas células CD4+ tienen generalmente un papel predefinido como linfocitos T colaboradores en el sistema inmunitario, aunque existen raras excepciones. Por ejemplo, hay subgrupos de células supresoras, linfocitos asesinos naturales (NK), y linfocitos citotóxicos en los que es conocida su expresión de CD4 (en el caso de los citotóxicos CD4, se han observado en números extremadamente bajos durante estadios específicos de enfermedad, y se consideran como inexistentes). Todos estos otros grupos celulares de linfocitos T CD4+ no se consideran como colaboradores, y por ende no se tratarán en este artículo.
La importancia de los linfocitos T colaboradores puede observarse durante una infección por VIH, virus que infecta las células que son tipo CD4+ (incluidos los linfocitos T colaboradores). Hacia el final de la infección por VIH, el número de células T CD4+ funcionales cae, lo que lleva al estado sintomático de la infección conocido como síndrome de inmunodeficiencia adquirida (SIDA). También hay desórdenes raros, de etiología casi siempre genética, que producen la ausencia o disfunción de linfocitos T CD4+. Este tipo de desórdenes produce síntomas similares a los del SIDA, y muchos de ellos son fatales, como en el caso de las Linfocitopenias.
Activación de linfocitos colaboradores
Luego de ocurrido el Desarrollo linfocitario, las células T vírgenes (aquellas que nunca han sido expuestas a un Antígeno al cual responden) abandonan el timo y comienzan a dispersarse a través del cuerpo, incluyendo los nódulos linfáticos. Como todo el linaje de células T, expresan el complejo Receptor de linfocitos T/CD3. Este receptor de células T (TcR) contiene regiones fijas y variables, siendo estas últimas las que determinan ante qué antígeno puede responder. Los linfocitos T CD4+ tienen TcRs con afinidad al MHC de clase II, y se cree que el CD4 está involucrado en la determinación de la afinidad al MHC durante el proceso de maduración en el timo.
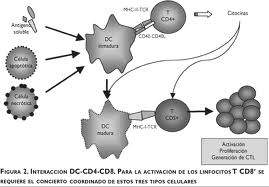
Las proteínas MHC de clase II sólo se encuentran en la superficie de las llamadas células presentadoras de antígeno (CPAs) profesionales. Las llamadas así profesionales son principalmente las Células dendríticas, Macrófagos y Linfocitos B, aunque las células dendríticas son el único grupo de células que expresan el MHC de clase II constitutivamente (todo el tiempo).
Algunas CPAs también se acoplan a antígenos nativos (o sin procesar) en su superficie, como las células dendríticas foliculares, pero los antígenos sin procesar no interaccionan con los linfocitos T y por ende no están involucrados en su activación. Los antígenos que se acoplan a las proteínas del MHC siempre son Péptidos cortos, de 8-10 aminoácidos de longitud, mientras que las que se acoplan al MHC de clase II son mayores, de hasta 25 aminoácidos.
Señalización 1
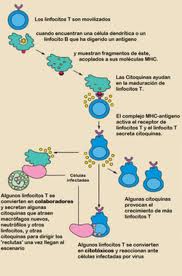
Durante una respuesta inmunológica, las células presentadoras de antígeno (CPAs) profesionales endocitan (absorben) el material foráneo (típicamente bacterias o virus), el cual sufre de un procesamiento para después viajar desde el sitio de la infección hasta un nódulo linfático. Una vez allí, la CPA comienza a presentar los péptidos del antígeno que están vinculados al MHC de clase II, permitiendo la activación a los linfocitos T CD4+ T que expresan TcRs específicos a ese complejo péptido/MHC.
Cuando un linfocito Th encuentra y reconoce el antígeno en una CPA, el complejo TcR/CD3 del linfocito se enlaza fuertemente al complejo péptido/MHC presente en la CPA profesional. El CD4, un co-receptor del complejo TcR, también se une a una sección diferente de la Molécula del MHC. Estas interacciones acercan a esas proteínas, permitiendo a las Quinasas en las porciones intracelulares de las proteínas TcR, CD3 y CD4, activarse unas a otras mediante Fosforilación. Con la asistencia de una Fosfatasa presente en la sección intracelular de la CD45 (antígeno común leucocitario), estas moléculas activan las vías bioquímicas principales en el citosol del linfocito Th. Estas vías ahora activas son conocidas como Señalización 1 de la activación de linfocitos T, ya que es la primera y principal señal pro-activación en la célula Th. Cuando ocurre un reencuentro con el mismo antígeno dado, los linfocitos T de memoria son reactivados usando las mismas vías TcR.
La unión del antígeno-MHC al complejo TcR y el CD4 pueden participar en la adhesión de la CPA y el linfocito Th durante el proceso de activación celular, pero son en realidad la proteína integrina LFA-1 en la superficie del linfocito T y la ICAM en la CPA las más importantes en este tipo de interacción.
Es desconocido el papel de la región extracelular relativamente grande del CD45 durante las interacciones celular, pero la CD45 tiene distintas isoformas que cambian en tamaño dependiendo del estado de activación y maduración de los linfocitos Th. Por ejemplo, el CD45 se reduce en longitud luego de la activación de Th(CD45RA+ a CD45RO+), pero es desconocido el hecho de que este cambio influencia o no la activación. Se ha propuesto que un CD45RA+ más largo pueda disminuir la accesibilidad del receptor de células T a la molécula antígeno-MHC, por ende necesitando un aumento en la afinidad (y especificidad) del linfocito T para activarse. Una vez ocurrida la activación, el CD45 se acorta, permitiendo interacciones más fáciles y una posterior activación como linfocito T efector.
Señalización 2
Una vez recibida la primera señal TcR/CD3, el linfocito T virgen debe activar una segunda vía bioquímica independiente, conocida como vía de Señalización 2. Este paso de "verificación" es una medida de protección que asegura que un linfocito T responde correctamente a un antígeno extraño. Si esta segunda señal no está presente durante la exposición inicial al antígeno, la célula T presume que es auto-reactivo. Esto conlleva a que la célula se vuelva anérgica (la anergia se genera por los cambios bioquímicos no protegidos de la Señalización 1). Las células anérgicas no responderán a ningún antígeno en el futuro, incluso si ambas señales se llevan a cabo. Se cree que estas células circulan por el cuerpo sin ninguna función ni valor, hasta que mueren al final de su ciclo vital.
La segunda señal involucra la interacción entre el CD28 en la superficie de los linfocitos T CD4+ y las proteínas CD80 (B7.1) o CD86 (B7.2) en las CPAs profesionales. Ambas moléculas, CD80 y CD86 activan el receptor CD28. Estas proteínas son también llamadas moléculas co-estimulatorias.
Aunque el estadio de verificación es necesario para la activación de los linfocitos T vírgenes, la importancia de este es demostrada durante los mecanismos de activación similares en linfocitos T citotóxicos CD8+. Debido a que los linfocitos T CD8+ vírgenes no tienen preferencias ante material proveniente de fuentes externas, éstas células T deben recaer en la activación de la CD28 para confirmar que están reconociendo un antígeno extraño (ya que la CD80/CD86 sólo se expresa por CPAs acttivas). Es por eso que la CD28 juega un papel importante en la disminución del riesgo de contraer una autoinmunidad por linfocitos T ante antígenos del organismo huésped (propio).
Una vez ambas vías de señalización han sido activadas, los cambios bioquímicos inducidos por la Señal 1 son alterados, permitiéndole a la célula activarse en lugar de quedar en estado de anergia. Entonces la segunda señal se vuelve obsoleta; sólo se requerirá de la primera señal para una futura activación. Esto también es cierto en linfocitos T de memoria, los cuales son ejemplo de inmunidad adquirida. Las respuestas más rápidas ocurren durante una reinfección, debido a que los linfocitos T de memoria ya han pasado por el proceso de confirmación y pueden crear células efectoras mucho más tempranamente.
Proliferación
Una vez ambas señales estimulatorias son activadas dentro del linfocito T colaborador, la célula se permite iniciar el proceso de proliferar. Logra esto al liberar un potente factor de crecimiento celular llamado interleucina-2 (IL-2). Los linfocitos T activados también producen la sub-unidad alfa del receptor IL-2 (CD25 o IL-2R), otorgándoles de un receptor plenamente funcional que puede unirse a la IL-2, el cual a su vez activa las vías de proliferación.
En este caso, la IL-2 liberada se acopla a los receptores IL-2 en la misma célula, lo cual potencia el proceso de proliferación. Este fenómeno en el que células liberan citoquinas para alterar su propio comportamiento es conocido como auto-regulación (o estimulación autocrina). Es de destacar que esta no es la única función de la IL-2 liberada (p. ej., los Linfocitos NK también proliferan cuando entran en contacto con esta IL-2), y que la IL-2 también puede unirse a otras células T en el área (estimulación paracrina).
Maduración
Luego de muchas generaciones celulares, los linfocitos Th progenitores se diferencian en linfocitos Th efectores, linfocitos Th de memoria, y linfocitos Th supresores.
- Linfocitos Th efectores: secretan Citoquinas, Proteínas o Péptidos que estimulan o interaccionan con otros Leucocitos, incluyendo linfocitos Th.
- Linfocitos Th de memoria: retienen la afinidad por el Antígeno de la célula T activada original, y son usados para actuar más tarde como células efectoras durante una segunda respuesta inmunitario (p. ej., si hay una reinfección del huésped más adelante).
- Linfocito T supresor: no promueve la función inmunitaria sino que la disminuye. A pesar de ser pocos en cantidad durante un proceso de infección, se cree que estas células juegan un papel importante en la auto-limitación del sistema inmunitario; han demostrado prevenir el desarrollo de varias Enfermedades autoinmunes.
La producción de IL-2 por parte de los linfocitos T colaboradores es también necesaria para aumentar la proliferación de linfocitos T CD8+. Sin las interacciones de los linfocitos T colaboradores, las células T CD8+ no podrían multiplicarse y eventualmente se volverían anérgicas. Esta asistencia-cruzada de los linfocitos T colaboradores es otra de las formas en las que el sistema inmunitario intenta prevenir una enfermedad autoinmune mediada por células T.
Respuesta efectora de linfocitos T
Los linfocitos T colaboradores son capaces de influenciar a otras células inmunitarias, y la respuesta generada (incluyendo las señales extracelulares como las citoquinas) podría ser esencial para la resolución de una infección. Para poder ser efectivos, los linfocitos T colaboradores deben determinar qué citoquinas le permiten al sistema inmunitario ser las más útiles o beneficiosas para el huésped. El entendimiento de cómo exactamente los linfocitos T responden a los desafíos al sistema inmunitario, es en la actualidad en tópico de gran interés en la Inmunología, ya que tal conocimiento podría ser útil en el tratamiento de la enfermedad además de aumentar la efectividad del proceso de vacunación.
Modelo de linfocitos Th1/Th2
El linaje de linfocitos T que se desarrolla a células efectoras se diferencia en dos grandes tipos de células conocidas como Th1 y Th2 (la "h" viene del término inglés helper que significa colaborador) o también conocidas como linfocitos T de tipo 1 y tipo 2, respectivamente.
| Tipo 1/ Th1 |
Tipo 2/ Th2 | |
| Tipo de célula con la que colabora principalmente |
Macrófago |
Linfocito B |
| Citoquinas producidas |
interferón gamma y factor de necrosis tumoral-beta. (La interleucina-2 se asociaba clásicamente con los linfocitos Th1, pero esta asociación puede no ser correcta; la IL-2 es producida tempranamente por todos los linfocitos T colaboradores durante su activación). |
interleucina-4, interleucina-5, interleucina-6, interleucina-10, interleucina-13. |
| Estimulación inmune promovida |
Sistema inmunitario celular. Maximiza la eficacia destructora de los macrófagos y la proliferación de linfocitos T citotóxicos CD8+. |
Sistema inmunitario humoral. Estimula la proliferación de linfocitos B para luego inducir la producción de anticuerpos. |
| Otras funciones |
La citoquina de tipo 1, el interferón gamma, aumenta la producción de interleucina-12 por las células dendríticas y macrófagos mediante una retroalimentación positiva. IL-12 estimula la producción de IFN-gamma en los linfocitos T colaboradores, y a su vez promoviendo el perfil Th1. El IFN-gamma también inhibe la producción de citoquina como la interleucina-4, citoquina importante asociada con la respuesta de Tipo 2, y por ende también actúa para preservar su propia respuesta. |
La respuesta Tipo 2 promueve su propio perfil usando dos citoquinas distintas. La Interleucina-4 actúa en los linfocitos T colaboradores para promover la producción de citoquinas Th2 (incluyendo la suya propia; es auto-regulatoria), mientras que la interleucina-10 (IL-10) inhibe una variedad de citoquinas incluyendo la interleucina-2 y el interferón gamma en linfocitos T y la IL-12 en células dendríticas y macrófagos. La acción combinada de estas dos citoquinas sugiere que una vez la célula T ha decidido producir estas citoquinas, se preserva la decisión (y también promueve a otras células T a hacer lo mismo). |
Se conoce acerca de los patrones de producción de Citoquinas de los linfocitos T, pero no se comprende aún cómo se decide qué patrón utilizar. Algunas evidencias sugieren que el tipo de CPA que presenta el antígeno al linfocito T, tiene una influencia mayoritaria en su perfil. Otras evidencias sugieren que la concentración de antígeno presentado a la célula T durante su activación primaria influencia su escogencia. La presencia de algunas citoquinas (como las mencionadas arriba) también influencia la respuesta que se generará eventualmente, pero el entendimiento del proceso está lejos de ser completo.
Limitaciones del modelo Th1/Th2
Las interacciones entre las citoquinas del modelo Th1/Th2 pueden ser más complicadas en algunos animales. Por ejemplo, la citoquina Th2 IL-10 inhibe la producción de los tipos de citoquinas Th en seres humanos. La IL-10 humana (hIL-10) detiene la proliferación y producción de citoquinas en todas las células T además de la actividad de los macrófagos, pero continua estimulando a las células plasmáticas, asegurando que se continúe la producción de anticuerpos. Como tal, no se cree que la hIL-10 verdaderamente promueva la respuesta Th2 en humanos, pero actúa para prevenir la sobre-estimulación de linfocitos T colaboradores, mientras al mismo tiempo maximiza la producción de anticuerpos.
También hay otros tipos de células T que pueden influenciar la expresión y activación de los linfocitos T colaboradores, tales como los linfocitos T reguladores, junto con algunos perfiles de citoquinas poco comunes como los linfocitos T del grupo Th3. Los términos "regulador" y "supresión" se han vuelto ambiguos luego del descubrimiento de que los linfocitos T CD4 también son capaces de regular (y suprimir) su propia respuesta sin necesidad de células de supresión dedicadas.
Otra diferencia importante con los linfocitos T "supresores" (o "reguladores naturales") es que éstos siempre suprimirán las acciones del sistema inmunitario, mientras que los grupos de células T efectoras comienzan con citoquinas de función promotora-inmune y luego cambiarán más adelante su repertorio a citoquinas inhibitorias. Esto último es lo que ocurre en células Th3, las cuales inician acciones propias de un grupo supresor luego de su producción de citoquinas y activación inicial.
Ambos grupos de células, los linfocitos T reguladores y los Th3 producen la citoquina denominada factor de crecimiento transformante β (TGF-β) e IL-10. Ambas citoquinas son inhibitorias de la actividad de linfocitos T colaboradores; el TGF-β suprime la actividad de la mayoría del sistema inmunitario. Existe evidencia sugierendo que el TGF-β puede no suprimir los linfocitos Th2 tan efectivamente como lo hace con linfocitos T vírgenes, pero no se considera típicamente como citoquina Th2.
Muchas de las citoquinas citadas en este artículo también son expresadas por otras células del sistema inmunitario y se hace claro que aunque el modelo básico Th1/Th2 brinda luces y permite comprender las funciones de los linfocitos T colaboradores, es demasiado simple para definir su rol o acciones totales. Algunos inmunólogos cuestionan el modelo en su totalidad, ya que algunos estudios in vivo sugieren que las células T colaboradoras, no desarrollan individualmente los perfiles de citoquinas específicos del modelo Th, y que muchas expresan citoquinas de ambos perfiles. Dicho eso, es de destacar la importancia del modelo Th en el desarrollo de nuestro entendimiento acerca de las labores y comportamiento de los linfocitos T colaboradores, junto con las citoquinas que ellos producen durante una respuesta inmunitario.
Papel durante la enfermedad
Considerando los diversos e importantes papeles que juegan los linfocitos T en el sistema inmunitario, no es de sorprender que estas células influencian la respuesta inmunitario contra la enfermedad. A veces también cometen equivocaciones ocasionales, o generan respuestas que podrían ser consideradas como no-benéficas. En la peor situación, la respuesta de los linfocitos T podría llevar al desastre y al fallecimiento del organismo hospedador. Afortunadamente, esto ocurre muy raras veces.
Colaboradores y Reacciones de hipersensibilidad
El sistema inmunitario debe lograr un balance de sensibilidad para poder responder a antígenos externos y evitar la respuesta con antígenos del propio organismo. Cuando el sistema inmunitario responde ante niveles muy bajos de antígenos con los que usualmente no debería responder, ocurre una respuesta de hipersensibilidad. Se conoce que la hipersensibilidad es la causa de alergias y algunas Enfermedades autoinmunes.
Las reacciones de hipersensibilidad pueden ser divididas en cuatro tipos:
- La Hipersensibilidad de tipo 1 incluye desórdenes comunes como el Asma, Rinitis alérgica (fiebre del heno), Eccema, Urticaria y Anafilaxis. Todas estas reacciones incluyen anticuerpos IgE, los cuales necesitan de una respuesta Th2 durante el desarrollo de las células T colaboradoras. Los tratamientos preventivos, como aquellos que usan Fármacos corticosteroides y Montelukast, se enfocan en suprimir los Mastocitos u otras células promotoras de la alergia; los linfocitos T no hacen ninguna función primaria en la respuesta inflamatoria como tal. Es importante notar que la categorización numérica de los "tipos" de hipersensibilidad, no se correlaciona (y no tiene nada que ver) con la "respuesta" en el modelo Th.
- Las reacciones de hipersensibilidad de Tipos 2 y 3 involucran complicaciones debidas a anticuerpos de baja afinidad o autoinmunes. En ambos tipos de reacción, los linfocitos T juegan un papel "cómplice" en la generación de estos anticuerpos auto-específicos, aunque algunas de estas reacciones de hipersensibilidad del Tipo 2 pueden ser consideradas como normales en un sistema inmunitario saludable (por ejemplo, reacciones de factor Rhesus contra los antígenos del bebé por la diferencia de grupos sanguíneos madre-hijo durante el parto). Nuestra comprensión del papel de los linfocitos T colaboradores en estas respuestas es limitado, pero se cree que las citoquinas producidas por Th2 podrían promover tales desórdenes. Por ejemplo, algunos estudios han sugerido que el Lupus (LES) y otras enfermedades autoinmunes de naturaleza similar pueden ser vinculadas a la producción de citoquinas Th2.
- La hipersensibilidad de Tipo 4, también conocida como hipersensibilidad tardía, son causadas mediante la sobreestimulación de las células inmunitarias, comúnmente linfocitos y macrófagos, lo que resulta en una inflamación crónica y liberación de citoquinas. Los anticuerpos no realizan una actividad importante en este tipo de alergia. Los linfocitos T son importantes en este tipo de hipersensibilidad, ya que son activados por el propio estímulo y promueven la activación de otras células, particularmente macrófagos vía citoquinas Th1.
Otros tipos de hipersensibilidad celular incluyen la enfermedad autoinmune mediada por linfocitos T citotóxicos, además de un fenómeno similar; rechazo de transplantes. Los linfocitos T colaboradores son necesarios para el desarrollo de estas enfermedades. Para lograr crear suficientes células T asesinas auto-reactivas, debe producirse interleucina-2, y esta es suministrada por los linfocitos T CD4+. Los linfocitos T CD4+ pueden estimular a su vez a células tales como linfocitos asesinos naturales y macrófagos mediante citoquinas como el interferón gamma, provocando a estas células citotóxicas a destruir células del organismo hospedador en ciertas circunstancias.
El mecanismo que usan las células T asesinas durante la autoinmunidad es casi idéntico a su respuesta contra virus, y algunos virus han sido acusados de causar enfermedades autoinmunes como la Diabetes mellitus tipo 1. Este tipo de enfermedades ocurre debido a que los sistemas de reconocimiento del antígeno en el organismo hospedador fallan, y el sistema inmunitario cree, por error, que un antígeno propio es exógeno o desconocido. Como resultado, los linfocitos T CD8+ tratan a la célula como si estuviese infectada, y entonces provocan la destrucción total(o en el caso de transplantes, el rechazo del órgano) de las células que expresan ese antígeno.
Es importante indicar que los mecanismos aquí explicados son una simplificación, y que muchas enfermedades autoinmunes son mucho más complejas; un ejemplo bien conocido es la Artritis reumatoide, en el que el conjunto de células y anticuerpos está involucrado en su Patología. De manera general, la Inmunología de muchas enfermedades autoinmunes no es aún comprendida en su totalidad.
Infección por VIH
Quizá el mejor ejemplo de la importancia de los linfocitos TCD4+ es demostrada con la infección por el virus de inmunodeficiencia humana (VIH). El VIH hace blanco en las células que expresan CD4, y por ende pueden infectar macrófagos, Células dendríticas (ambos grupos expresan CD4 en bajos niveles) y por supuesto, los linfocitos T CD4+.
Se ha propuesto que durante la Fase asintomática de la infección por VIH, el virus tiene una afinidad relativamente baja hacia las células T (y tiene una más alta afinidad por los macrófagos), resultando en una baja tasa de eliminación de linfocitos T CD4+ por el sistema inmunitario. Esto se compensa inicialmente mediante la producción de nuevos linfocitos T colaboradores desde el timo (originalmente de la médula ósea). Sin embargo, una vez el virus se vuelve 'linfotrópico' (o T-trópico), comienza a infectar linfocitos T CD4+ de una manera tan eficiente (probablemente debido a cambios en los co-receptores a los que se enlaza durante la infección), que el sistema inmunitario es abrumado y vencido.
En ese momento, los niveles de linfocitos T CD4+ funcionales comienzan a disminuir, hasta el punto en el que la población de células T CD4+ es muy pequeña como para reconocer el rango total de antígenos que pueden ser potencialmente detectados. La falta de cubrimiento antigénico total comienza a producir los síntomas principales del síndrome de inmunodeficiencia adquirida (SIDA). La eliminación de los linfocitos T CD4 durante el sida, permite que varios patógenos escapen al reconocimiento, permitiendo entonces una infección oportunista. Muchas de las infecciones aumentan en severidad y/o duración debido a que la disminución de linfocitos provoca una contribución más débil en el sistema inmunitario para responder ante ellas.
Particularmente, dos componentes del sistema inmunitario son afectados debido a su dependencia en los linfocitos T CD4+:
- Los linfocitos T CD8+ no son estimulados tan efectivamente durante la fase sintomática de la infección por VIH, haciendo a los pacientes con sida muy susceptibles a muchos virus, incluyendo el propio VIH. Este decremento en la eliminación de los linfocitos T CD4+ afectados, provoca que el virus se produzca más (los linfocitos T CD4+ no mueren lo suficientemente rápido), aumentando la proliferación del virus, y acelerando el desarrollo de la enfermedad.
- La conmutación de clase de inmunoglobulina disminuye significativamente una vez que fallan las funciones de los linfocitos T colaboradores. El sistema inmunitario pierde su habilidad para mejorar la afinidad de sus anticuerpos, y se vuelve incapaz de generar linfocitos B que produzcan grupos de anticuerpos como IgG e IgA. Estos efectos se producen principalmente debido a la pérdida del número de linfocitos T colaboradores que pueden interaccionar correctamente con los linfocitos B. Otro síntoma del sida es la reducción en los niveles de anticuerpos debido a la disminución de las citoquinas Th2 (y menores interacciones por los linfocitos T colaboradores). Todas esas complicaciones acaban en una susceptibilidad aumentada ante infecciones bacterianas, especialmente en áreas del cuerpo no accesibles por anticuerpos IgM.
Si el paciente no responde al (o no recibe) tratamiento contra el VIH, eventualmente sucumbirá a cáncer o infecciones; finalmente, el sistema inmunitario llega a un nivel en el que ya no está coordinado o estimulado lo suficiente como para afrontar la enfermedad.
Fuente
- Lis Linfocitos T CD4
*CD4
CD4 y CD8:Lab de Referencia - Papel de los linfocitos T CD4
- Linfocitos T CD4 positivos
Enlaces externos
- http://revistas.um.es/analesvet/article/view/952
- http://biblioteca.universia.net/html_bura/ficha/params/title/linfocitos-t-cd4-cd25-high-relacion-estado-inmunologico-pacientes-portadores/id/49383169.html
- http://todo-en-salud.com/investigacion-medica/reduccion-del-descenso-de-linfocitos-t-cd4-y-de-la-activacion-inmune-mediante-nr100157-una-intervencion-nutricional-especifica-in-pacientes-vih-que-no-reciben-tratamiento-arv-bite
- http://revista.inmunologia.org/Upload/Articles/3/7/370.pdf
- http://dialnet.unirioja.es/servlet/articulo?codigo=2188542
- http://caibco.ucv.ve/caibco/vitae/VitaeVeintiseis/Articulos/Inmunologia/ArchivosHTM/introduccionvih.htm
- http://decs.es/anatomia/linfocitos-t-cd4-positivos/
- http://atlas.med.uchile.cl/19.htm
- http://www.elementos.buap.mx/num49/htm/31.htm
- http://bvs.sld.cu/revistas/hih/vol12_1_96/hih07196.htm
- http://revista.seaic.es/junio98/160-166.pdf