Radiactividad
| ||||||
Radiactividad. La radiactividad se define como la propiedad de algunos elementos químicos que consiste en la desintegración espontánea ( radiactividad natural ) o provocada ( radiactividad artificial ) de sus núcleos atómicos mediante la emisión de partículas subatómicas llamadas partículas alfa y partículas beta, y de radiaciones electromagnéticas denominadas rayos X y Rayos Gamma.
Sumario
Historia del descubrimiento
El fenómeno fue descubierto en 1896 por el físico francés Antoine Henri Becquerel. Éste realizó los primeros estudios sobre radiactividad natural, observando que las sales de uranio podían ennegrecer una placa fotográfica aunque estuvieran separadas de la misma por una placa de vidrio o un papel negro. También comprobó que los rayos que producían el oscurecimiento podían descargar un electroscopio, lo que indicaba que poseían carga eléctrica. Por ello dedujo que estaba ante un nuevo tipo de radiaciones ( no conocidas hasta entonces ) a las que se les llamó rayos de Becquerel.
En 1898, los químicos franceses Marie y Pierre Curie dedujeron que la radiactividad es un fenómeno asociado a los átomo, por lo que ninguno de los agentes físicos o químicos conocidos influían en la emisión de la radiación. También llegaron a la conclusión de que la pechblenda, un mineral de uranio, tenía que contener otros elementos radiactivos ya que presentaba una radiactividad más intensa que las sales de uranio empleadas por Becquerel. El matrimonio Curie llevó a cabo una serie de tratamientos químicos de la pechblenda que condujeron al descubrimiento de dos nuevos elementos radiactivos, el polonio y el radio. Marie Curie observó que entre los elementos conocidos en aquella época, además del uranio, el torio también era radiactivo.
En 1899, el químico francés André Louis Debierne descubrió otro elemento radiactivo, el actinio. Ese mismo año, los físicos británicos Ernest Rutherford y Frederick Soddy descubrieron el gas radiactivo radón, observado en asociación con el torio, el actinio y el radio. Esto apoyaba el fenómeno de la radiactividad inducida (Marie Curie, 1899 ).
Se reconoció que la radiactividad era la fuente de energía más potente que se conocía hasta entonces. Los Curie midieron el calor asociado con la desintegración del radio y establecieron que 1 gramo de radio desprende aproximadamente unos 420 julios (100 calorías) de energía cada hora. Este efecto de calentamiento continúa hora tras hora y año tras año, mientras que la combustión completa de un gramo de carbón produce un total de 34.000 julios (unas 8.000 calorías) de energía.
Tras estos primeros descubrimientos, la radiactividad atrajo la atención de científicos de todo el mundo. En las décadas siguientes se investigaron a fondo muchos aspectos del fenómeno.
Tipos de radiación
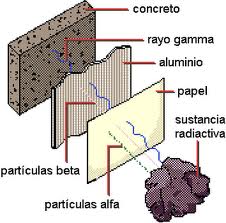
Rutherford descubrió que las emisiones radiactivas contienen al menos dos componentes: partículas alfa, que sólo penetran unas milésimas de centímetro, y partículas beta, que son casi 100 veces más penetrantes. En experimentos posteriores se sometieron las emisiones radiactivas a campos eléctricos y magnéticos, y de esta forma se descubrió que había un tercer componente, los rayos gamma, que resultaron ser mucho más penetrantes que las partículas beta.
En un campo eléctrico, la trayectoria de las partículas beta se desvía mucho hacia el polo positivo, mientras que la de las partículas alfa lo hace en menor medida hacia el polo negativo; los rayos gamma no son desviados en absoluto. Esto indica que las partículas beta tienen carga negativa, las partículas alfa tienen carga positiva (se desvían menos porque son más pesadas que las partículas beta) y los rayos gamma son eléctricamente neutros. El descubrimiento de que la desintegración del radio produce radón demostró que en la desintegración radiactiva se produce un cambio en la naturaleza química del elemento que se desintegra.
Los experimentos sobre la desviación de partículas alfa en un campo eléctrico demostraron que la relación entre la carga eléctrica y la masa de estas partículas es aproximadamente la mitad que la del ion hidrógeno. Los físicos supusieron que las partículas podían ser iones helio con carga doble (átomos de helio a los que les faltaban dos electrones). El ion helio tiene una masa aproximadamente cuatro veces mayor que el de hidrógeno, lo que supondría que su relación carga-masa sería la mitad que la del ion de hidrógeno. Esta suposición fue demostrada por Rutherford. Más tarde se demostró que las partículas beta eran electrones, mientras que los rayos gamma eran radiaciones electromagnéticas de la misma naturaleza que los rayos X pero con una energía bastante mayor.
Hipótesis nuclear
En la época en que se descubrió la radiactividad, los físicos creían que el átomo era el bloque de materia último e indivisible. Después, se comprobó que las partículas alfa y beta ( unidades de materia) , a través de la radiactividad transforman los átomos en nuevos tipos de átomos con propiedades químicas nuevas. Esto hizo que se reconociera que los átomos deben tener una estructura interna, y que no son las partículas últimas y fundamentales de la naturaleza.
En 1911, Rutherford demostró la existencia de un núcleo en el interior del átomo mediante experimentos en los que se desviaban partículas alfa con láminas delgadas de metal. Desde entonces, la hipótesis nuclear ha evolucionado hasta convertirse en una teoría de la estructura atómica, que permite explicar todo el fenómeno de la radiactividad. Es decir, se ha comprobado que el átomo está formado por un núcleo central muy denso, rodeado por una nube de electrones. El núcleo, a su vez, está compuesto de protones, cuyo número es igual al de los electrones (en un átomo no ionizado), y de neutrones. Los neutrones son eléctricamente neutros, y su masa es aproximadamente igual a la de los protones.
Una partícula alfa (un núcleo de helio con carga doble) está formada por dos protones y dos neutrones, por lo que sólo puede ser emitida por el núcleo de un átomo. Cuando un núcleo pierde una partícula alfa se forma un nuevo núcleo, más ligero que el original en cuatro unidades de masa (las masas del neutrón y el protón son de una unidad aproximadamente). Cuando un átomo del isótopo de uranio con número másico 238 emite una partícula alfa, se convierte en un átomo de otro elemento, con número másico 234. Como la carga del uranio 238 disminuye en dos unidades como resultado de la emisión alfa, el número atómico del átomo resultante es menor en dos unidades al original, que era de 92. El nuevo átomo tiene un número atómico de 90, y es un isótopo del elemento torio.
El torio 234 emite partículas beta (electrones). La emisión beta se produce a través de la transformación de un neutrón en un protón, y entonces aumenta la carga nuclear (o número atómico) en una unidad. La masa de un electrón es despreciable, por lo que el isótopo producido por la desintegración del torio 234 tiene un número másico de 234 y un número atómico de 91; se trata de un isótopo del protactinio. Las emisiones alfa y beta suelen ir junto con la emisión gamma. Los rayos gamma no poseen carga ni masa; por lo tanto no suponen cambios en la estructura del núcleo, sino la pérdida de una determinada cantidad de energía radiante.
Con la emisión de estos rayos, el núcleo compensa el estado inestable tras los procesos alfa y beta. La partícula alfa o beta primaria y su rayo gamma asociado se emiten casi a la vez. Sin embargo, se conocen algunos casos de procesos alfa o beta no acompañados de rayos gamma o al contrario ( isómeros nucleares, mismo número atómico y número másico pero distintas energías. Ej: isótopo protactinio 234).
Series de desintegración radiactiva
Cuando el uranio 238 se desintegra mediante emisión alfa, se forma torio 234; éste es un emisor beta y se desintegra para formar protactinio 234, que a su vez, es un emisor beta que da lugar a un nuevo isótopo del uranio, el uranio 234. Este isótopo se desintegra mediante emisión alfa para formar torio 230, que se desintegra mediante emisión alfa y produce el isótopo radio 226.
Esta serie de desintegración radiactiva, denominada serie uranio-radio, continúa de forma similar con otras cinco emisiones alfa y otras cuatro emisiones beta hasta llegar al producto final, un isótopo no radiactivo (estable) del plomo (el elemento 82) con número másico 206. En esta serie están representados todos los elementos de la tabla periódica situados entre el uranio y el plomo. Todos los miembros de esta serie tienen un rasgo común: si se resta 2 a sus números másicos se obtienen números exactamente divisibles por 4, es decir, sus números másicos pueden expresarse mediante la sencilla fórmula 4n + 2, donde n es un número entero. Otras series radiactivas naturales son la serie del torio, llamada serie 4n y la serie del actinio o serie 4n + 3. El elemento original de la serie del torio es el isótopo torio 232, y su producto final es el isótopo estable plomo 208. La serie del actinio empieza con el uranio 235 y acaba en el plomo 207.
En los últimos años se ha descubierto y estudiado en profundidad una cuarta serie, la serie 4n + 1, en la que todos son elementos radiactivos artificiales. Su miembro inicial es un isótopo del elemento artificial curio, el curio 241, y su producto final es el bismuto 209. Una aplicación del conocimiento de los elementos radiactivos es la determinación de la edad de la Tierra. Se puede saber la edad de una roca ya que en muchos minerales de uranio y torio (que llevan desintegrándose desde su formación), las partículas alfa han quedado atrapadas (en forma de átomos de helio) en el interior de la roca. Sabiendo con precisión las cantidades de helio, uranio y torio que hay en la roca, se puede calcular el tiempo que llevan ocurriendo los procesos de desintegración (es decir, la edad de la roca).
Este método nos dice que la edad de la Tierra oscila en torno a unos 4.600 millones de años. Se han obtenido valores similares en meteoritos que han caído a la superficie terrestre y en muestras lunares traídas por el Apollo 11 en julio de 1969, lo que indica que todo el Sistema Solar tiene probablemente una edad similar a la Tierra.
Radiactividad artificial
Todos los isótopos naturales situados por encima del bismuto en la tabla periódica son radiactivos. Además también existen isótopos naturales radiactivos del bismuto, el talio, el vanadio, el indio, el neodimio, el gadolinio, el hafnio, el platino, el plomo, el renio, el lutecio, el rubidio, el potasio, el hidrógeno, el carbono, el lantano y el samario.
En 1919, Rutherford provocó la primera reacción nuclear inducida artificialmente al bombardear gas nitrógeno corriente (nitrógeno 14) con partículas alfa. Comprobó que los núcleos del nitrógeno capturaban estas partículas y emitían protones muy rápidamente, con lo que formaban un isótopo estable del oxígeno, el oxígeno 17. Esta reacción puede escribirse en notación simbólica como: wN + nHe ± xO + eH Por convenio, se escriben los números atómicos de los núcleos implicados como subíndices y a la izquierda de sus símbolos químicos, y sus números másicos como superíndices. En la reacción anterior, la partícula alfa se expresa como un núcleo de helio, y el protón como un núcleo de hidrógeno.
Hasta 1933 no se demostró que estas reacciones nucleares podían llevar en ocasiones a la formación de nuevos núcleos radiactivos. Los químicos franceses Irène y Frèdéric Joliot-Curie produjeron aquel año la primera sustancia radiactiva bombardeando aluminio con partículas alfa. Los núcleos de aluminio capturaban estas partículas y emitían neutrones, con lo que se formaba un isótopo de fósforo que se desintegraba en un periodo de semidesintegración muy corto.
Los Joliot-Curie también produjeron un isótopo de nitrógeno a partir de boro, y uno de aluminio a partir de magnesio. Desde entonces se han descubierto muchas reacciones nucleares, y se han bombardeado los núcleos de todos los elementos de la tabla periódica con distintas partículas, entre ellas partículas alfa, protones, neutrones y deuterones (núcleos de deuterio, el isótopo de hidrógeno de número másico 2).
Como resultado de esta investigación intensiva se conocen en la actualidad más de 400 elementos radiactivos artificiales, además a favorecido al desarrollo de aceleradores de partículas que comunican velocidades enormes a las partículas empleadas en el bombardeo.
El estudio de las reacciones nucleares y la búsqueda de nuevos isótopos radiactivos artificiales, sobre todo entre los elementos más pesados, llevó al descubrimiento de la fisión nuclear y al posterior desarrollo de la bomba atómica.
También se descubrieron varios elementos nuevos que no existen en la naturaleza. El desarrollo de reactores nucleares hizo posible la producción a gran escala de isótopos radiactivos de casi todos los elementos de la tabla periódica, y la disponibilidad de estos isótopos supone una ayuda incalculable para la investigación química y biomédica.
Entre los isótopos radiactivos producidos artificialmente tiene gran importancia el carbono 14, con un periodo de semidesintegración de 5.730 ± 40 años. La disponibilidad de esta sustancia ha permitido investigar numerosos aspectos de procesos vitales, como la fotosíntesis, con mayor profundidad.
En la atmósfera terrestre existe una cantidad minúscula de carbono 14, y todos los organismos vivos lo asimilan durante su vida. Después de la muerte, esta asimilación se interrumpe, y el carbono radiactivo, que se desintegra continuamente, deja de tener una concentración constante.
Las medidas del contenido de carbono 14 permiten calcular la edad de objetos de interés histórico o arqueológico, como huesos o momias. Otras aplicaciones de los isótopos radiactivos se dan en la terapia médica, la radiografía industrial, y ciertos dispositivos específicos como fuentes de luz fosforescente, eliminadores de electricidad estática, calibres de espesor o pilas nucleares.
Lluvia radiactiva
Se define como la deposición de partículas radiactivas, liberadas en la atmósfera por explosiones nucleares o escapes de instalaciones y centrales nucleares, sobre la superficie de la Tierra. El interés de la opinión pública se ha centrado sobre todo en los efectos de la lluvia radiactiva desde el periodo de las pruebas nucleares atmosféricas a gran escala realizadas en las décadas de 1950 y comienzos de la de 1960.
Se habló sobre sus efectos dañinos durante muchos años, pero hasta 1984 no se adoptó una decisión , cuando un juez federal de Utah dictaminó que 10 personas habían enfermado de cáncer debido a que el gobierno no había tomado las medidas adecuadas en cuanto a la exposición de los ciudadanos a la lluvia radiactiva en aquel estado.
En 1985 el Tribunal de apelación de pensiones de Inglaterra y Gales llegó a una conclusión similar en el caso de un veterano de las pruebas nucleares británicas en las islas Christmas durante la década de 1950. Desde la firma del tratado de limitación de pruebas nucleares en 1963, los niveles de lluvia radiactiva han disminuido en todo el mundo. El accidente nuclear de Chernobil produjo cierta cantidad de lluvia radiactiva.
Mecanismo
El material del que se compone la lluvia radiactiva se produce por la energía nuclear y por la activación del suelo, el aire, el agua y otros materiales en las inmediaciones del lugar de la detonación. Las partículas radiactivas individuales son invisibles, y tan ligeras que podrían dar vueltas una y otra vez en torno al planeta sin llegar a descender a la superficie (sólo si una bomba nuclear fuera detonada fuera de la atmósfera). Cuando un arma nuclear es detonada, buena parte del material es absorbido hacia la bola de fuego (masa caliente que se eleva formando una nube en forma de hongo). En el interior de la bola de fuego y en el tallo de la nube de la bomba, las partículas radiactivas se adhieren a partículas más pesadas.
Las partículas de materia de mayor masa caen de vuelta a la tierra en cuestión de minutos, formando una lluvia radiactiva muy localizada. Las partículas de masa menor, pero fácilmente visibles, arrastradas por el viento, caen a tierra al cabo de varias horas, y reciben el nombre de lluvia radiactiva local. Si la explosión es de escasa potencia, la nube de la bomba puede no alcanzar la tropopausa. En casos así, se produce la llamada lluvia radiactiva troposférica, y los fragmentos de la bomba se desplazan siguiendo la latitud donde se produjo la detonación y cayendo a la superficie cuando la lluvia arrastra la materia extraña de la atmósfera. Si la explosión es de mucha potencia los residuos alcanzan la estratosfera. La lluvia producida en este caso recibe el nombre de lluvia atómica estratosférica o global. Estas partículas permanecen en suspensión durante considerables periodos.
Riesgos potenciales
El riesgo que representaría la lluvia radiactiva en una guerra nuclear sería mucho más serio que en una prueba nuclear. Habría que considerar los efectos letales inmediatos y los efectos a largo plazo. Este hecho ha llevado a la construcción de refugios nucleares como parte de los planes de defensa civil. Se están desarrollando sistemas para descontaminar el agua, la tierra y los alimentos con el fin de combatir los posibles efectos de la lluvia radiactiva durante y después de un ataque nuclear.
Muchas investigaciones que aunque algunos seres humanos sobrevivieran a una guerra nuclear a gran escala, probablemente serían estériles. En caso de producirse un accidente en una central con liberación de residuos radiactivos, la tierra podría quedar contaminada en muchos kilómetros a la redonda. Para impedir esto, los ingenieros nucleares diseñan los sistemas intentando impedir el riesgo de fugas accidentales.
Efectos biológicos de la radiación
La radiación tiene consecuencias sobre los tejidos de los organismos vivos. Se transfiere energía a las moléculas de las células de estos tejidos. Como resultado las células pueden deteriorarse de forma temporal o permanente y ocasionar incluso la muerte de las mismas. Los efectos de la radiación son los mismos, tanto si ésta procede del exterior, como si procede de un material radiactivo situado en el interior del cuerpo.
Los efectos biológicos de una misma dosis de radiación varían de forma considerable según el tiempo de exposición. Los efectos que aparecen tras una irradiación rápida se deben a la muerte de las células y pueden hacerse visibles pasadas horas, días o semanas. Dosis altas de radiación sobre todo el cuerpo, producen lesiones características. La radiación absorbida se mide en grays (1 gray es la cantidad de radiación necesaria para liberar 1 julio de energía por kilogramo de materia).
Una cantidad de radiación superior a 400.000 grays produce un deterioro severo en el sistema vascular humano, que desemboca en edema cerebral, trastornos neurológicos y coma profundo. El individuo muere en las 48 horas siguientes. Cuando el organismo absorbe de 100.000 a 400.000 grays de radiación. El individuo muere en los diez días siguientes a consecuencia del desequilibrio osmótico, del deterioro de la médula ósea y de la infección terminal. Si la cantidad absorbida oscila entre 15.000 y 100.000 grays, se destruye la médula ósea provocando infección y hemorragia. La persona puede morir cuatro o cinco semanas después de la exposición. La mitad de las personas que han recibido una radiación de 30.000 a 32.500 grays y que no hayan recibido tratamiento, pierden la médula ósea.
La irradiación de zonas concretas del cuerpo produce daños locales en los tejidos. Se lesionan los vasos sanguíneos de las zonas expuestas alterando las funciones de los órganos. Cantidades más elevadas, desembocan en gangrena. No es probable que una irradiación interna, cause trastornos graves. Dependerá del órgano en cuestión y de su vida media. El tejido irradiado puede destruirse o desarrollar un cáncer.
Radiación no ionizante
Durante mucho tiempo se ha creído que la frecuencia de radiación de redes o tendidos eléctricos, radares, canales o redes de comunicación y hornos de microondas era perjudicial y que producía quemaduras, cataratas, esterilidad temporal, etc. Se han observado algunas consecuencias biológicas poco importantes pero se desconoce por el momento qué repercusión tienen sobre la salud.
Fuentes
- Varios autores. 1972. Monitor. Director: Manuel Salvat.Ed. Salvat. V-10, Pamplona.
- Varios autores. 1991. Larousse.Ed. Planeta. Volumen-7, Barcelona.
- Varios autores. 1990. Nueva Enciclopedia Temática Planeta. Ed. Planeta. Volumen-3, Barcelona.
- Varios autores. 1989. Crónica de la Técnica.Ed. Plaza & Janes. Madrid.