Diferencia entre revisiones de «Enlace covalente»
| Línea 1: | Línea 1: | ||
{{Desarrollo}} | {{Desarrollo}} | ||
| + | <div align="justify"> | ||
{{Definición | {{Definición | ||
|nombre='''Enlace covalente''' | |nombre='''Enlace covalente''' | ||
|imagen= Enlace_covalente.jpg | |imagen= Enlace_covalente.jpg | ||
|tamaño= 200 × 117px | |tamaño= 200 × 117px | ||
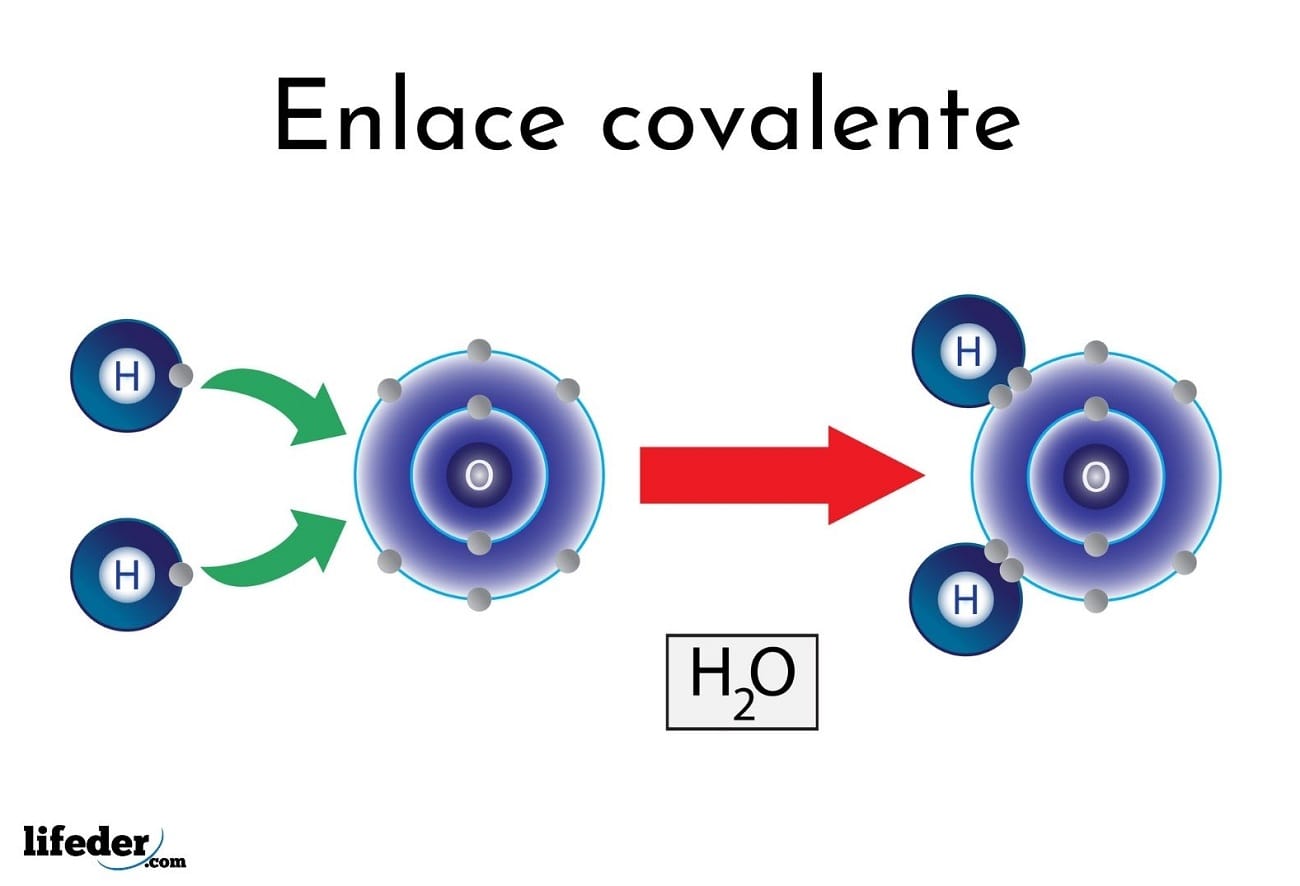
| − | |concepto= | + | |concepto= Se produce por la compartición de electrones, entre los átomos que se enlazan, y como consecuencia de esto, disminuye la energía del sistema atómico. |
| − | }} | + | }}'''Enlace covalente''',se forma por compartición de uno o más pares de electrones entre los átomos de diferente o igual electronegatividad que forman la molécula. <br> |
| − | '''Enlace covalente''',se forma por compartición de uno o más pares de electrones entre los átomos de diferente o igual electronegatividad que forman la molécula. <br> | ||
==Estructura de las sustancias== | ==Estructura de las sustancias== | ||
El enlace covalente es característico de la unión de los [[elemento]]s [[químico]]s no metálicos entre si, que no difieren grandemente en sus [[energía]]s de [[ionización]] y [[electrafinidad]]es. | El enlace covalente es característico de la unión de los [[elemento]]s [[químico]]s no metálicos entre si, que no difieren grandemente en sus [[energía]]s de [[ionización]] y [[electrafinidad]]es. | ||
Revisión del 07:38 7 oct 2011
| ||||||
Estructura de las sustancias
El enlace covalente es característico de la unión de los elementos químicos no metálicos entre si, que no difieren grandemente en sus energías de ionización y electrafinidades.
Referencias
- Colectivo de autores: Química. Tomo I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1969.
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros; Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1985.
- Mahan, B.H: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1975.
Fuentes
- http://www.unalmed.edu.co/~cgpaucar/ENLACES.html
- http://www.visionlearning.com/library/module_viewer.php?mid=55&l=s
- http://www.sabelotodo.org/materia/enlaces.html
- http://usuarios.multimania.es/ptro2/fourphotogalery.html
Enlace relacionado