Diferencia entre revisiones de «Amiloidosis»
(Etiqueta: no tiene enlaces internos) |
|||
| Línea 1: | Línea 1: | ||
| − | {{Enfermedad|nombre=Amiloidosis primaria|imagen_del_virus=Amiloidosis_primaria.jpg|imagen_de_los_sintomas=Ritmo cardíaco irregular|clasificacion=|region_de_origen=|region_mas_comun=Tejidos y órganos|region _mas_comun=|agente_transmisor=|forma_de_propagacion=|vacuna=}} | + | {{Enfermedad|nombre=Amiloidosis primaria|imagen_del_virus=Amiloidosis_primaria.jpg|imagen_de_los_sintomas=Ritmo cardíaco irregular|clasificacion=|region_de_origen=|region_mas_comun=Tejidos y órganos|region _mas_comun=|agente_transmisor=|forma_de_propagacion=|vacuna=}}<br> |
| + | |||
| + | == Amiloide y amiloidosis == | ||
| + | |||
| + | === Amiloide<br> === | ||
| + | |||
| + | Es un nombre genérico para designar diversas sustancias que tienen en común estar contituidas por proteína fibrilar b-plegada. Este tipo de estructura no ocurre normalmente en las proteínas de los mamíferos. En nombre de amiloide, dado por Virchow, se debe a la similitud con el almidón en cuanto a la afinidad tintorial con el yodo. | ||
| + | |||
| + | El depósito de amiloide es extracelular y corresponde siempre a una condición patológica, la amiloidosis, no rara vez progresiva y letal. El daño local principal que produce la infiltración amiloidea es la atrofia. Estos depósitos pueden ser localizados (en un órgano), o generalizados (en muchos órganos). Las amiloidosis constituyen un grupo heterogéneo de enfermedades puesto que las cadenas polipeptídicas del amiloide tienen diversa composición de amino-ácidos. Sin embargo, la estructura física del amiloide (figura 2.7) es similar en todas las sustancias amiloídeas conocidas. Su componente principal es la fibrilla amiloídea, que está formada por dos filamentos helicoidales y que tiene 7 a 10 nm de diámetro. Las fibrillas amiloideas son visibles fácilmente al microscopio electrónico y aparecen dispuestas desordenamente. El amiloide tiene, además, el componente P, que es una glicoproteína, y el componente C, matriz amiloídea químicamente heterogénea.<br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | De acuerdo con la secuencia aminoacídica de la fibrilla amiloidea, se distinguen diversos tipos de amiloide. En cada tipo se ha encontrado en el suero sanguíneo de los enfermos, una proteína precursora, que tiene la misma secuencia aminoacídica que la del amiloide del caso depositado en los tejidos. En la nomenclatura actual los tipos de amiloide se designan abreviadamente, de la siguiente manera: S significa proteína sérica precursora; a continuación, A significa amiloide, y la letra que le sigue denota el tipo. Los principales tipos son los siguientes: A (proteína A, obtenida de la fase aguda), L (cadena liviana de inmunoglobulina), F (familiar), E (endocrina) y S (senil). Así por ejemplo, SAL significa: proteína sérica precursora del amiloide de cadena liviana de inmunoglobulina.<br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | == Patogenia<br> == | ||
| + | |||
| + | Un importante avance en la comprensión de la patogenia de la amiloidosis, ha sido el hallazgo de proteínas séricas precursoras. En principio, esto permitiría detener o reducir el depósito de amiloide en los tejidos bajando el nivel sanguíneo de la proteína precursora o eliminándola. Sin embargo, no se conoce exactamente el mecanismo por el cual se produce el depósito en los tejidos a partir de la proteína sérica. Se cree que se realiza por clivaje enzimático. Por este mecanismo se ha logrado obtener in vitro fibrillas amiloídeas a partir de proteína de Bence-Jones, que corresponde a cadenas polipeptídicas livianas kappa o lambda. Pero no siempre se logra formar fibrillas. Además, in vivo en el mieloma, en que se excretan grandes cantidades de proteína de Bence-Jones por la orina, no se producen siempre depósitos de sustancia amiloídea. Lo mismo sucede en el amiloide AA: sólo bajo ciertas circunstancias se obtiene in vitro fibrilla amiloídea. El precursor sérico del amiloide AA es un componente normal del suero humano que se comporta como una proteína reactiva en la fase aguda y que aumenta en las inflamaciones, infecciones, traumatismos, cirugía, tumores diseminados y otras condiciones patológicas. Pero la causa de la transformación in vivo de esta proteína en fibrilla amiloídea es desconocida. Experimentalmente se ha podido comprobar que el suero humano tiene capacidad de degradar fibrillas AA; en cambio, el suero de pacientes con artritis reumatoide tiene esta capacidad muy reducida, como también el suero de algunos pacientes con inflamaciones crónicas. En la actualidad se tiende a pensar que el depósito amiloídeo es un proceso dinámico en el que, por una parte, hay una constante neoformación de fibrillas amiloídeas a partir de precursores séricos, pero también existe una degradación constante de estas mismas fibrillas que llegan sólo a la amiloidosis cuando el segundo proceso es excedido por el primero.<br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | == Reconocimiento del Amiloide == | ||
| + | |||
| + | Los órganos con amiloidosis presentan aumento de volumen a pesar de la atrofia parenquimatosa que produce la infiltración amiloidea; la consistencia está aumentada, es firme y elástica; la superficie de corte es vítrea. Si uno corta de un órgano macizo comprometido como el hígado, una lámina de un par de milímetros de espesor y la coloca sobre una hoja con un texto escrito, se puede leer éste a través del tejido.<br>El amiloide se reconoce sólo mediante métodos morfológicos. En tejidos frescos de autopsias, mediante la prueba del lugol. Se sumerge por unos minutos un corte delgado de tejido fresco, el tejido con infiltración amiloidea toma una color caoba. Si este corte de tejido se sumerge en una solución de ácido sulfúrico al 5%, el color vira a un tono verde-azulado con que se destaca mejor la zona comprometida. El reconocimiento histológico se hace mediante la tinción con Rojo de Congo, colorante que tiñe al amiloide de color pardo rojizo. El tejido así teñido debe ser examinado bajo luz polarizada, con la que el amiloide presenta característicamente un dicroismo verde. Dicroismo es la propiedad de ciertos cristales birrefringentes de absorber en una determinada dirección, uno de los rayos polarizados, de manera que el cristal, en esa dirección, parece de otro color: si la luz incidente es blanca, en esa dirección aparece del color complementario al del rayo absorbido. Si antes de realizar la tinción de Rojo de Congo el tejido es tratado con una solución de permanganato de potasio, un grupo de sustancias amiloídeas deja de teñirse con Rojo de Congo y de mostrar el dicroismo:es el amiloide sensible al permanganato de potasio, que corresponde generalmente a las forma AA (figura 2.9). Las substancias amiloideas resistentes al permanganato de potasio corresponden, entre otros, a los amiloides AL, AS, endocrinos y familiares con neuropatía. El examen mediante el microscopio electrónico permite reconocer con seguridad pequeñas cantidades de sustancia amiloídea al demostrar las fibrillas típicas. El método inmunohistoquímico con el uso de anticuerpos específicos de cada tipo, está comenzando a usarse en la actualidad.<br>Se distinguen dos formas de distribución: la generalizada y la localizada en un órgano.<br><br> | ||
== Amiloidosis primaria<br> == | == Amiloidosis primaria<br> == | ||
| − | Es un trastorno en el cual las fibras de proteínas se depositan en tejidos y órganos, causándoles daño.<br>Causas<br>La causa de la amiloidosis primaria se desconoce, pero esta afección está relacionada con una producción anormal de anticuerpos por parte de un tipo de células inmunitarias llamadas células plasmáticas.<br>Los síntomas dependen de los órganos que se ven afectados por los depósitos, como la lengua, los intestinos, los músculos esqueléticos y lisos, los nervios, la piel, los ligamentos, el corazón, el hígado, el bazo y los riñones.<br><br> | + | Es un trastorno en el cual las fibras de [[proteínas]] se depositan en tejidos y órganos, causándoles daño.<br>Causas<br>La causa de la amiloidosis primaria se desconoce, pero esta afección está relacionada con una producción anormal de anticuerpos por parte de un tipo de células inmunitarias llamadas células plasmáticas.<br>Los síntomas dependen de los órganos que se ven afectados por los depósitos, como la lengua, los intestinos, los músculos esqueléticos y lisos, los nervios, la piel, los ligamentos, el corazón, el hígado, el bazo y los riñones.<br><br> |
== La amiloidosis primaria puede ocasionar las siguientes afecciones:<br> == | == La amiloidosis primaria puede ocasionar las siguientes afecciones:<br> == | ||
| Línea 19: | Línea 59: | ||
== <br>Pruebas y exámenes == | == <br>Pruebas y exámenes == | ||
| − | El médico puede descubrir que usted presenta hepatomegalia o esplenomegalia.<br>Si se sospecha el daño de un órgano específico, el médico puede ordenar exámenes para confirmar la amiloidosis en dicho órgano. Por ejemplo:<br>• Una ecografía abdominal puede mostrar hepatomegalia o esplenomegalia<br>• Una biopsia de la almohadilla de grasa abdominal, una biopsia de la mucosa rectal o una biopsia de médula ósea pueden ayudar a confirmar el diagnóstico.<br>• Una evaluación cardíaca, incluyendo ECG puede mostrar arritmias, sonidos cardíacos anormales o signos de insuficiencia cardíaca. Una ecocardiografía muestra un movimiento deficiente de la pared del corazón debido a la rigidez del músculo cardíaco (miocardiopatía)<br>• Una evaluación para síndrome del túnel carpiano puede mostrar que el agarre de la mano es débil. La velocidad de conducción del nervio muestra anomalías.<br>• Los exámenes de la función renal pueden mostrar signos de insuficiencia renal o demasiada proteína en la orina ( síndrome nefrótico) <br>o El nivel BUN se incrementa<br>o La creatinina en suero es elevada<br>o Un análisis de orina muestra proteínas, cilindros o cuerpos grasos<br>Esta enfermedad también puede alterar los resultados de los siguientes exámenes:<br>• Proteína cuantitativa de Bence-Jones <br>• Biopsia del túnel carpiano <br>• Biopsia de la encía <br>• Inmunoelectroforesis en suero <br>• Biopsia del miocardio <br>• Biopsia de nervio <br>• Inmunoglobulinas cuantitativas <br>• Biopsia de la lengua <br>• Proteína en orina | + | El [[médico]] puede descubrir que usted presenta hepatomegalia o esplenomegalia.<br>Si se sospecha el daño de un órgano específico, el médico puede ordenar exámenes para confirmar la amiloidosis en dicho órgano.<br> |
| + | |||
| + | Por ejemplo:<br>• Una ecografía abdominal puede mostrar hepatomegalia o esplenomegalia<br>• Una biopsia de la almohadilla de grasa abdominal, una biopsia de la mucosa rectal o una biopsia de médula ósea pueden ayudar a confirmar el diagnóstico.<br>• Una evaluación cardíaca, incluyendo ECG puede mostrar arritmias, sonidos cardíacos anormales o signos de insuficiencia cardíaca. Una ecocardiografía muestra un movimiento deficiente de la pared del corazón debido a la rigidez del músculo cardíaco (miocardiopatía)<br>• Una evaluación para síndrome del túnel carpiano puede mostrar que el agarre de la mano es débil. La velocidad de conducción del nervio muestra anomalías.<br>• Los exámenes de la función renal pueden mostrar signos de insuficiencia renal o demasiada proteína en la orina ( síndrome nefrótico) <br>o El nivel BUN se incrementa<br>o La creatinina en suero es elevada<br>o Un análisis de orina muestra proteínas, cilindros o cuerpos grasos<br>Esta enfermedad también puede alterar los resultados de los siguientes exámenes:<br>• Proteína cuantitativa de Bence-Jones <br>• Biopsia del túnel carpiano <br>• Biopsia de la encía <br>• Inmunoelectroforesis en suero <br>• Biopsia del miocardio <br>• Biopsia de nervio <br>• Inmunoglobulinas cuantitativas <br>• Biopsia de la lengua <br>• Proteína en orina | ||
== <br>Tratamiento == | == <br>Tratamiento == | ||
| − | Algunos de los pacientes afectados por amiloidosis primaria responden a la quimioterapia dirigida a las células plasmáticas anormales. Se puede usar el trasplante de células madre, como en el mieloma múltiple.<br>En la amiloidosis secundaria, un tratamiento agresivo de la enfermedad subyacente puede mejorar los síntomas y/o disminuir la progresión de la misma. Complicaciones como la insuficiencia cardíaca, la insuficiencia renal y otros problemas algunas veces se pueden tratar en la medida de lo necesario. | + | Algunos de los pacientes afectados por amiloidosis primaria responden a la quimioterapia dirigida a las [[células]] plasmáticas anormales. Se puede usar el trasplante de células madre, como en el mieloma múltiple.<br>En la amiloidosis secundaria, un tratamiento agresivo de la enfermedad subyacente puede mejorar los síntomas y/o disminuir la progresión de la misma. Complicaciones como la insuficiencia cardíaca, la insuficiencia renal y otros problemas algunas veces se pueden tratar en la medida de lo necesario. |
== <br>Expectativas (pronóstico) == | == <br>Expectativas (pronóstico) == | ||
| Línea 33: | Línea 75: | ||
Consulte con el médico si aparecen síntomas acordes con el desarrollo de amiloidosis primaria.<br>Si usted sabe que tiene amiloidosis primaria, llame al médico si se presenta dificultad respiratoria, hinchazón persistente de los tobillos u otras áreas, disminución en el gasto urinario u otros síntomas, lo cual puede indicar que se han producido complicaciones. | Consulte con el médico si aparecen síntomas acordes con el desarrollo de amiloidosis primaria.<br>Si usted sabe que tiene amiloidosis primaria, llame al médico si se presenta dificultad respiratoria, hinchazón persistente de los tobillos u otras áreas, disminución en el gasto urinario u otros síntomas, lo cual puede indicar que se han producido complicaciones. | ||
| − | == | + | == Fuente == |
| − | + | *Manual de Patología General.<br> | |
| + | *hBuxbaum JN. The Amyloidoses. In: Goldman L, Ausiello D. Cecil Textbook of Medicine. 22nd ed. Philadelphia, Pa: WB Saunders; 2004. | ||
| + | *Hoffman R, Benz Jr. EJ, Shattil SJ, et al., eds. Hematology: Basic Principles and Practice. 4th ed. Philladelphia, Pa: Churchill Livingston; 2005:1540-48.<br><br> | ||
| − | <br> | + | == Véase Además en:<br> == |
| − | + | *[ttp://www.infomed.sld.cu Página Web INFOMED.]<br> | |
| − | <br> | + | == Enlaces Externos.<br> == |
| − | *http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000533.htm | + | *http://es.wikipedia.org/wiki/Amiloidosis.<br> |
| − | + | *ttp://www.nlm.nih.gov/medlineplus/spanish/ency/article/000533.htm. <br> | |
| − | * | + | *www.institutferran.org/amiloidosis.htm<br> |
[[Category:Patología_clínica]] | [[Category:Patología_clínica]] | ||
| + | |||
| + | <br> | ||
Revisión del 11:50 29 dic 2010
| ||||||||
Sumario
- 1 Amiloide y amiloidosis
- 2 Patogenia
- 3 Reconocimiento del Amiloide
- 4 Amiloidosis primaria
- 5 La amiloidosis primaria puede ocasionar las siguientes afecciones:
- 6 Síntomas
- 7 Otros síntomas que pueden estar asociados con esta enfermedad son:
- 8 Pruebas y exámenes
- 9 Tratamiento
- 10 Expectativas (pronóstico)
- 11 Cuándo contactar a un profesional médico
- 12 Fuente
- 13 Véase Además en:
- 14 Enlaces Externos.
Amiloide y amiloidosis
Amiloide
Es un nombre genérico para designar diversas sustancias que tienen en común estar contituidas por proteína fibrilar b-plegada. Este tipo de estructura no ocurre normalmente en las proteínas de los mamíferos. En nombre de amiloide, dado por Virchow, se debe a la similitud con el almidón en cuanto a la afinidad tintorial con el yodo.
El depósito de amiloide es extracelular y corresponde siempre a una condición patológica, la amiloidosis, no rara vez progresiva y letal. El daño local principal que produce la infiltración amiloidea es la atrofia. Estos depósitos pueden ser localizados (en un órgano), o generalizados (en muchos órganos). Las amiloidosis constituyen un grupo heterogéneo de enfermedades puesto que las cadenas polipeptídicas del amiloide tienen diversa composición de amino-ácidos. Sin embargo, la estructura física del amiloide (figura 2.7) es similar en todas las sustancias amiloídeas conocidas. Su componente principal es la fibrilla amiloídea, que está formada por dos filamentos helicoidales y que tiene 7 a 10 nm de diámetro. Las fibrillas amiloideas son visibles fácilmente al microscopio electrónico y aparecen dispuestas desordenamente. El amiloide tiene, además, el componente P, que es una glicoproteína, y el componente C, matriz amiloídea químicamente heterogénea.
De acuerdo con la secuencia aminoacídica de la fibrilla amiloidea, se distinguen diversos tipos de amiloide. En cada tipo se ha encontrado en el suero sanguíneo de los enfermos, una proteína precursora, que tiene la misma secuencia aminoacídica que la del amiloide del caso depositado en los tejidos. En la nomenclatura actual los tipos de amiloide se designan abreviadamente, de la siguiente manera: S significa proteína sérica precursora; a continuación, A significa amiloide, y la letra que le sigue denota el tipo. Los principales tipos son los siguientes: A (proteína A, obtenida de la fase aguda), L (cadena liviana de inmunoglobulina), F (familiar), E (endocrina) y S (senil). Así por ejemplo, SAL significa: proteína sérica precursora del amiloide de cadena liviana de inmunoglobulina.
Patogenia
Un importante avance en la comprensión de la patogenia de la amiloidosis, ha sido el hallazgo de proteínas séricas precursoras. En principio, esto permitiría detener o reducir el depósito de amiloide en los tejidos bajando el nivel sanguíneo de la proteína precursora o eliminándola. Sin embargo, no se conoce exactamente el mecanismo por el cual se produce el depósito en los tejidos a partir de la proteína sérica. Se cree que se realiza por clivaje enzimático. Por este mecanismo se ha logrado obtener in vitro fibrillas amiloídeas a partir de proteína de Bence-Jones, que corresponde a cadenas polipeptídicas livianas kappa o lambda. Pero no siempre se logra formar fibrillas. Además, in vivo en el mieloma, en que se excretan grandes cantidades de proteína de Bence-Jones por la orina, no se producen siempre depósitos de sustancia amiloídea. Lo mismo sucede en el amiloide AA: sólo bajo ciertas circunstancias se obtiene in vitro fibrilla amiloídea. El precursor sérico del amiloide AA es un componente normal del suero humano que se comporta como una proteína reactiva en la fase aguda y que aumenta en las inflamaciones, infecciones, traumatismos, cirugía, tumores diseminados y otras condiciones patológicas. Pero la causa de la transformación in vivo de esta proteína en fibrilla amiloídea es desconocida. Experimentalmente se ha podido comprobar que el suero humano tiene capacidad de degradar fibrillas AA; en cambio, el suero de pacientes con artritis reumatoide tiene esta capacidad muy reducida, como también el suero de algunos pacientes con inflamaciones crónicas. En la actualidad se tiende a pensar que el depósito amiloídeo es un proceso dinámico en el que, por una parte, hay una constante neoformación de fibrillas amiloídeas a partir de precursores séricos, pero también existe una degradación constante de estas mismas fibrillas que llegan sólo a la amiloidosis cuando el segundo proceso es excedido por el primero.
Reconocimiento del Amiloide
Los órganos con amiloidosis presentan aumento de volumen a pesar de la atrofia parenquimatosa que produce la infiltración amiloidea; la consistencia está aumentada, es firme y elástica; la superficie de corte es vítrea. Si uno corta de un órgano macizo comprometido como el hígado, una lámina de un par de milímetros de espesor y la coloca sobre una hoja con un texto escrito, se puede leer éste a través del tejido.
El amiloide se reconoce sólo mediante métodos morfológicos. En tejidos frescos de autopsias, mediante la prueba del lugol. Se sumerge por unos minutos un corte delgado de tejido fresco, el tejido con infiltración amiloidea toma una color caoba. Si este corte de tejido se sumerge en una solución de ácido sulfúrico al 5%, el color vira a un tono verde-azulado con que se destaca mejor la zona comprometida. El reconocimiento histológico se hace mediante la tinción con Rojo de Congo, colorante que tiñe al amiloide de color pardo rojizo. El tejido así teñido debe ser examinado bajo luz polarizada, con la que el amiloide presenta característicamente un dicroismo verde. Dicroismo es la propiedad de ciertos cristales birrefringentes de absorber en una determinada dirección, uno de los rayos polarizados, de manera que el cristal, en esa dirección, parece de otro color: si la luz incidente es blanca, en esa dirección aparece del color complementario al del rayo absorbido. Si antes de realizar la tinción de Rojo de Congo el tejido es tratado con una solución de permanganato de potasio, un grupo de sustancias amiloídeas deja de teñirse con Rojo de Congo y de mostrar el dicroismo:es el amiloide sensible al permanganato de potasio, que corresponde generalmente a las forma AA (figura 2.9). Las substancias amiloideas resistentes al permanganato de potasio corresponden, entre otros, a los amiloides AL, AS, endocrinos y familiares con neuropatía. El examen mediante el microscopio electrónico permite reconocer con seguridad pequeñas cantidades de sustancia amiloídea al demostrar las fibrillas típicas. El método inmunohistoquímico con el uso de anticuerpos específicos de cada tipo, está comenzando a usarse en la actualidad.
Se distinguen dos formas de distribución: la generalizada y la localizada en un órgano.
Amiloidosis primaria
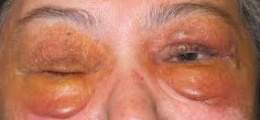
Es un trastorno en el cual las fibras de proteínas se depositan en tejidos y órganos, causándoles daño.
Causas
La causa de la amiloidosis primaria se desconoce, pero esta afección está relacionada con una producción anormal de anticuerpos por parte de un tipo de células inmunitarias llamadas células plasmáticas.
Los síntomas dependen de los órganos que se ven afectados por los depósitos, como la lengua, los intestinos, los músculos esqueléticos y lisos, los nervios, la piel, los ligamentos, el corazón, el hígado, el bazo y los riñones.
La amiloidosis primaria puede ocasionar las siguientes afecciones:
• Síndrome del túnel carpiano
• Reflujo gastrointestinal (ERGE)
• Daño al músculo cardíaco (miocardiopatía)
• Insuficiencia renal
• Malabsorsión
Los depósitos se acumulan en los órganos afectados, provocando que se vuelvan rígidos, lo cual disminuye su capacidad de funcionamiento.
Aún no se han identificado los factores de riesgo. La amiloidosis primaria es poco común. Es similar al mieloma múltiple y se trata de la misma manera.
Síntomas
• Agrandamiento de la lengua
• Fatiga
• Ritmo cardíaco irregular
• Entumecimiento de manos y pies
• Dificultad respiratoria
• Cambios en la piel
• Dificultades para deglutir
• Hinchazón de brazos y piernas
• Debilidad para agarrar con la mano
• Pérdida de peso
Otros síntomas que pueden estar asociados con esta enfermedad son:
• Heces color arcilla
• Disminución del gasto urinario
• Diarrea
• Ronquera o cambios en la voz
• Dolor articular
• Otros problemas linguales
• Debilidad
Pruebas y exámenes
El médico puede descubrir que usted presenta hepatomegalia o esplenomegalia.
Si se sospecha el daño de un órgano específico, el médico puede ordenar exámenes para confirmar la amiloidosis en dicho órgano.
Por ejemplo:
• Una ecografía abdominal puede mostrar hepatomegalia o esplenomegalia
• Una biopsia de la almohadilla de grasa abdominal, una biopsia de la mucosa rectal o una biopsia de médula ósea pueden ayudar a confirmar el diagnóstico.
• Una evaluación cardíaca, incluyendo ECG puede mostrar arritmias, sonidos cardíacos anormales o signos de insuficiencia cardíaca. Una ecocardiografía muestra un movimiento deficiente de la pared del corazón debido a la rigidez del músculo cardíaco (miocardiopatía)
• Una evaluación para síndrome del túnel carpiano puede mostrar que el agarre de la mano es débil. La velocidad de conducción del nervio muestra anomalías.
• Los exámenes de la función renal pueden mostrar signos de insuficiencia renal o demasiada proteína en la orina ( síndrome nefrótico)
o El nivel BUN se incrementa
o La creatinina en suero es elevada
o Un análisis de orina muestra proteínas, cilindros o cuerpos grasos
Esta enfermedad también puede alterar los resultados de los siguientes exámenes:
• Proteína cuantitativa de Bence-Jones
• Biopsia del túnel carpiano
• Biopsia de la encía
• Inmunoelectroforesis en suero
• Biopsia del miocardio
• Biopsia de nervio
• Inmunoglobulinas cuantitativas
• Biopsia de la lengua
• Proteína en orina
Tratamiento
Algunos de los pacientes afectados por amiloidosis primaria responden a la quimioterapia dirigida a las células plasmáticas anormales. Se puede usar el trasplante de células madre, como en el mieloma múltiple.
En la amiloidosis secundaria, un tratamiento agresivo de la enfermedad subyacente puede mejorar los síntomas y/o disminuir la progresión de la misma. Complicaciones como la insuficiencia cardíaca, la insuficiencia renal y otros problemas algunas veces se pueden tratar en la medida de lo necesario.
Expectativas (pronóstico)
La gravedad de esta enfermedad depende de los órganos que han sido afectados. El compromiso del corazón y de los riñones puede conducir a una insuficiencia de estos órganos y a la muerte. El compromiso sistémico está asociado con la muerte en un período de 1 a 3 años.
Posibles complicaciones
• Insuficiencia cardíaca congestiva
• Muerte
• Insuficiencia endocrina (trastorno hormonal)
• Insuficiencia renal
• Insuficiencia respiratoria
Cuándo contactar a un profesional médico
Consulte con el médico si aparecen síntomas acordes con el desarrollo de amiloidosis primaria.
Si usted sabe que tiene amiloidosis primaria, llame al médico si se presenta dificultad respiratoria, hinchazón persistente de los tobillos u otras áreas, disminución en el gasto urinario u otros síntomas, lo cual puede indicar que se han producido complicaciones.
Fuente
- Manual de Patología General.
- hBuxbaum JN. The Amyloidoses. In: Goldman L, Ausiello D. Cecil Textbook of Medicine. 22nd ed. Philadelphia, Pa: WB Saunders; 2004.
- Hoffman R, Benz Jr. EJ, Shattil SJ, et al., eds. Hematology: Basic Principles and Practice. 4th ed. Philladelphia, Pa: Churchill Livingston; 2005:1540-48.
Véase Además en:
- [ttp://www.infomed.sld.cu Página Web INFOMED.]
Enlaces Externos.
- http://es.wikipedia.org/wiki/Amiloidosis.
- ttp://www.nlm.nih.gov/medlineplus/spanish/ency/article/000533.htm.
- www.institutferran.org/amiloidosis.htm