Diferencia entre revisiones de «Ácido fluorhídrico»
| (No se muestran 3 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Elemento_químico | {{Elemento_químico | ||
|nombre=Ácido fluorhídrico | |nombre=Ácido fluorhídrico | ||
| − | |imagen= | + | |imagen=Acido fluorhidrico.JPG |
|nombre,simbolo,numero= ácido fluorhídrico (HF). | |nombre,simbolo,numero= ácido fluorhídrico (HF). | ||
|serie_quimica= El '''ácido fluorhídrico''' es compuestos formados por [[hidrógeno]] y el [[flúor]].}} | |serie_quimica= El '''ácido fluorhídrico''' es compuestos formados por [[hidrógeno]] y el [[flúor]].}} | ||
| Línea 36: | Línea 36: | ||
* En la síntesis del UF6, que es utilizado para separar isótopos del [[uranio]]. | * En la síntesis del UF6, que es utilizado para separar isótopos del [[uranio]]. | ||
* En la industria nuclear se utiliza para la manufactura y reprocesamiento de los elementos combustibles. | * En la industria nuclear se utiliza para la manufactura y reprocesamiento de los elementos combustibles. | ||
| − | * Elaboración de [[pantallas]] para [[ | + | * Elaboración de [[pantallas]] para [[computadora]]s. |
* [[Bombillas fluorescentes]] | * [[Bombillas fluorescentes]] | ||
* [[Grabado|Grabados]] al [[agua]] fuerte en [[vidrio]] | * [[Grabado|Grabados]] al [[agua]] fuerte en [[vidrio]] | ||
| Línea 83: | Línea 83: | ||
* Mantenga el producto lejos de fuentes de calor. | * Mantenga el producto lejos de fuentes de calor. | ||
* Mantenga lejos de productos [[reactivos]]. | * Mantenga lejos de productos [[reactivos]]. | ||
| − | * Use una barrera alrededor de los recipientes de almacenamiento e instalación | + | * Use una barrera alrededor de los recipientes de almacenamiento e instalación de transferencia. |
| − | de transferencia. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Fuentes == | == Fuentes == | ||
| − | * [http:// | + | * Artículo [http://quiminet.com/pr6/Acido%2Bfluorhidrico.htm Ácido fluorhídrico]. Disponible en "quiminet.com". Consultado: 20 de Agosto de 2011. |
| − | * [http://www.nlm.nih.gov/medlineplus/spanish/ency/article/002499.htm nlm | + | * Artículo [http://www.nlm.nih.gov/medlineplus/spanish/ency/article/002499.htm Ácido fluorhídrico]. Disponible en "www.nlm.nih.gov". Consultado: 20 de Agosto de 2011. |
| − | * [http:// | + | * Artículo [http://www.solvaychemicals.us/static/wma/pdf/5/1/4/6/HF70-SP.pdf Ácido fluorhídrico]. Disponible en "www.solvaychemicals.us". Consultado: 18 de Agosto de 2011. |
| − | [[Category: Química]] | + | [[Category: Química]][[Category:Elementos químicos]] |
Revisión del 14:28 22 abr 2013
| ||||||||||
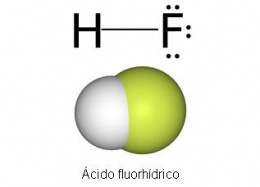
Ácido fluorhídrico. Tambien nombrado ácido hidrofluórico, es un ácido inorgánico muy fuerte, lo contituye la solución acuosa de fluoruro de hidrógeno, la forma más común en el que podemos encontrarlo en la naturaleza es HF o (HF)6.
Sumario
Propiedades físicas y químicas
- Líquido incoloro
- Tóxico
- Altamente corrosivo.
- Solubilidad en Agua: 70 g/100 ml (20 °C, 293 K)
- Masa molecular: 20.01 g/mol.
- Punto de fusión: –83,15 °C
- Punto de ebullición: 19.85 °C
Obtención
El ácido fluorhídrico se obtiene por la reacción del fluoruro de calcio (CaF2) con el ácido sulfúrico.
H2SO4 + CaF2 -> CaSO4 + 2HF
Aplicaciones
- En la obtención de mucho compuestos farmacéuticos y polímeros.
- Se utiliza para la fabricación de compuestos fluorinados orgánicos e inorgánicos.
- Es la base para la producción de fluoroboratos, criolita (Na3AlF6) artificial que se emplea en la producción de aluminio, fluoruros, ácidos fluorados.
- Se utiliza en la refinación del petróleo. Como catalizador para la producción de gasolina en alto octanaje en la operación conocida como alquilación de la gasolina.
- Se utiliza ampliamente para opacar el vidrio.
- Como un magnífico limpiador y abrillantador de aluminio y acero inoxidable,
- En el tratamiento del titanio.
- La purificación de cuarzo
- En el terminado de metales.
- En la síntesis del UF6, que es utilizado para separar isótopos del uranio.
- En la industria nuclear se utiliza para la manufactura y reprocesamiento de los elementos combustibles.
- Elaboración de pantallas para computadoras.
- Bombillas fluorescentes
- Grabados al agua fuerte en vidrio
- Removedores de polvo de uso doméstico
Riesgos
Se trata de una sustancia irritante, corrosiva y tóxica
Síntomas por ingestión
- Incapacidad para respirar a medida que la garganta se inflama y se cierra Fiebre.
- Dolor abdominal fuerte.
- Fuerte dolor en la boca.
- Fuerte dolor de garganta.
- Vómito.
Síntomas por inhalación
- Labios y uñas de color azulado
- Escalofríos
- Asfixia
- Tos
- Fiebre
- Opresión en el pecho
Síntomas por el contacto
- Quemadura en la piel muy dolorosa
Manejo y almacenaje
Manejo
- Efectúe las operaciones industriales en el equipo y los circuitos de la tubería cerrados, pero con ventosas.
- Realice las manipulaciones a pequeña escala bajo campana aspirante.
- Opérese en un lugar bien ventilado.
- Use solamente equipos y materiales que sean compatibles con el fluoruro de hidrógeno.
- Manténgase lejos de productos reactivos (véase la sección 10).
- Transfiera de preferencia con bombas o gravedad.
Almacenamiento
- Conserve en un contenedor herméticamente cerrado.
- Almacene en un local aireado, fresco.
- Mantenga el producto lejos de fuentes de calor.
- Mantenga lejos de productos reactivos.
- Use una barrera alrededor de los recipientes de almacenamiento e instalación de transferencia.
Fuentes
- Artículo Ácido fluorhídrico. Disponible en "quiminet.com". Consultado: 20 de Agosto de 2011.
- Artículo Ácido fluorhídrico. Disponible en "www.nlm.nih.gov". Consultado: 20 de Agosto de 2011.
- Artículo Ácido fluorhídrico. Disponible en "www.solvaychemicals.us". Consultado: 18 de Agosto de 2011.