Diferencia entre revisiones de «Alquinos»
| (No se muestran 3 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Elemento_químico | {{Elemento_químico | ||
|nombre= Alquinos | |nombre= Alquinos | ||
| − | |imagen= | + | |imagen=Alquinos1.jpg |
| − | |nombre,simbolo,numero= | + | |nombre,simbolo,numero= C<sub>n</sub>H<sub>2n-2</sub> |
|serie_quimica= Hidrocarburos alifáticos no saturados | |serie_quimica= Hidrocarburos alifáticos no saturados | ||
|grupo,periodo,bloque= | |grupo,periodo,bloque= | ||
| Línea 27: | Línea 27: | ||
== Características generales de los alquinos == | == Características generales de los alquinos == | ||
| − | La fórmula empírica general de los alquinos es | + | La fórmula empírica general de los alquinos es C<sub>n</sub>H<sub>2n-2</sub>. Se conocen también como acetilenos, al ser el gas acetileno (HC≡CH, etino), el más simple de los alquinos. |
== Nomenclatura de alquinos == | == Nomenclatura de alquinos == | ||
| Línea 83: | Línea 83: | ||
== Obtención == | == Obtención == | ||
| − | Los alquinos se obtienen mediante reacciones de eliminación a partir de dihaloalcanos vecinales o geminales. Se obtiene acetileno por la simple adición controlada de agua al [[Carburo de calcio]] (CaC< | + | Los alquinos se obtienen mediante reacciones de eliminación a partir de dihaloalcanos vecinales o geminales. Se obtiene acetileno por la simple adición controlada de agua al [[Carburo de Calcio|Carburo de calcio]] (CaC<sub>2</sub>) a temperatura normal. Como el carburo de [[calcio]] es una sustancia muy barata, que sale de calentar cal viva (CaO) con [[Carbón]], el acetileno es un gas barato y fácil de producir. |
== Aplicaciones == | == Aplicaciones == | ||
última versión al 11:25 1 abr 2013
| ||||||||||
Los Alquinos son hidrocarburos alifáticos no saturados que tienen al menos un enlace triple carbono-carbono en la molécula.
Sumario
Características generales de los alquinos
La fórmula empírica general de los alquinos es CnH2n-2. Se conocen también como acetilenos, al ser el gas acetileno (HC≡CH, etino), el más simple de los alquinos.
Nomenclatura de alquinos
La IUPAC (International Union of Pure and Applied Chemistry), ha establecido que para nombrar los alquinos se sustituya la terminación ano de los homólogos alcanos por ino, indicando con números la posición del carbono con el triple enlace de la cadena más larga encontrada.
Ejemplo: CH3-CH2-CH3 (Propano)
CH≡CH-CH3 (Propino)
Serie homologa
| Fórmula | Nombre |
| CH≡CH | Etino (Acetileno) |
| CH≡C–CH3 | Propino |
| CH≡C–CH2–CH3 | 1-Butino |
| CH≡C-(CH2)2–CH3 | 1-Pentino |
| CH≡C-(CH2)3–CH3 | 1-Hexino |
| CH≡C–(CH2)4–CH3 | 1-Heptino |
| CH≡C–(CH2)5–CH3 | 1-Octino |
| CH≡C–(CH2)6–CH3 | 1-Nonino |
| CH≡C–(CH2)7–CH3 | 1-Decino |
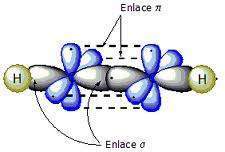
Estructura y enlace en alquinos
El triple enlace está compuesto por dos enlaces perpendiculares entre si, formados por Orbitales p no hibridados y un Enlace sigma formado por Híbridos sp.
Acidez del hidrógeno en alquinos terminales
Los alquinos terminales tienen Hidrógeno ácido de pKa=25 que se puede arrancar empleando bases fuertes, como el amiduro de sodio en Amoniaco líquido. La base conjugada (acetiluro) es un buen Nucleófilo por lo que se puede utilizar en reacciones de alquilación.
Estabilidad del triple enlace
La hiperconjugación estabiliza también los alquinos, el alquino interno es más estable que el terminal.
Obtención
Los alquinos se obtienen mediante reacciones de eliminación a partir de dihaloalcanos vecinales o geminales. Se obtiene acetileno por la simple adición controlada de agua al Carburo de calcio (CaC2) a temperatura normal. Como el carburo de calcio es una sustancia muy barata, que sale de calentar cal viva (CaO) con Carbón, el acetileno es un gas barato y fácil de producir.
Aplicaciones
Los Etilenos están presentes naturalmente en las plantas, pero el único miembro de la clase que tiene verdadera importancia industrial es el acetileno, que se usa ampliamente como materia prima para la obtención de otros productos orgánicos, y para la soldadura y corte de los metales, especialmente Hierro y Acero.
Propiedades físicas
Las propiedades físicas de los alquinos tienen, a groso modo, un comportamiento parecido a la de los Alcanos y Alquenos, Los puntos de fusión y ebullición de los alquinos son ligeramente superiores a los de los alcanos y alquenos correspondientes.
| Hidrocarburo | Pto Ebullición °C |
Pto Fusión °C |
|---|---|---|
| Etino | -57 | -81.15 |
| Eteno | -102 | -169 |
| Etano | -89 | -172 |
Propiedades químicas
Los alquinos a diferencia de los alquenos son muy reactivos, y pueden reaccionar con muchos agentes. En general la química de los alquinos, y en especial la del acetileno, como componente más abundante y barato, es compleja y peligrosa. Una importante parte de los compuestos producidos partiendo de este gas son sustancias explosivas. Usando ciertas condiciones, los alquinos pueden reaccionar con cationes metálicos para formar derivados metálicos sólidos (sales orgánicas).
Con el sodio, potasio y litio forman compuestos estables en seco, pero que se descomponen al hidrolizarlos (agregar agua) regenerándose el alquino original. Sin embargo los derivados metálicos del cobre y la plata, se pueden manipular de manera segura solo cuando están húmedos, si están secos, son muy inestables y pueden descomponerse con violencia explosiva al ser golpeados. Una mezcla de acetileno y cloro reacciona de manera explosiva al ser iluminada. Los alquinos también pueden ser polimerizados como los alquenos, estos son procesos complejos.
El ácido sulfúrico acuoso en presencia de Sulfato de mercurio como catalizador hidrata los alquinos, dando Cetonas. La hidroboración con boranos impedidos, seguida de oxidación con Agua oxigenada, produce Enoles que se Tautomerizan a Aldehídos o Cetonas. El Bromo molecular y los haluros de alquilo se adicionan a los alquinos de forma similar a los Alquenos.
Hidrogenación
La hidrogenación catalítica los convierte en Alcanos, aunque es posible parar en el Alqueno mediante catalizadores envenenados (lindlar). El sodio en amoniaco líquido hidrogena el alquino a alqueno trans, reacción conocida como Reducción monoelectrónica.
Isomerización de alquinos terminales
Dado que los alquinos internos son más estables que los terminales, en presencia de bases se produce la isomerización desde el extremo de la cadena hacia posiciones internas. Esta reacción se puede evitar trabajando a temperaturas bajas, por ello la base mas utilizada es el amiduro de sodio en amoniaco líquido que permite trabajar a -33ºC.