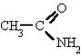
Amida
Las amidas son derivados funcionales de los ácidos carboxílicos, en los que se ha sustituido el grupo —OH por el grupo —NH2, —NHR o —NRR', con lo que resultan, respectivamente, las llamadas amidas primarias, secundarias o terciarias, que también se llaman amidas sencillas, N-sustituidas o N-disustituidas.
Sumario
Nomenclatura
Las amidas primarias se nombran sustituyendo la terminación oico o ico del nombre sistemático o vulgar, del ácido del que derivan, por el sufijo amida. En las amidas sustituidas se antepone al nombre anterior el de los radicales sobre el nitrógeno, precedidos de la letra N.
Propiedades físicas
El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida (p.f.=2,5 ºC), sean todas sólidas y solubles en agua. Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas.
Los puntos de fusión y de ebullición de las amidas secundarias son bastante menores, debido principalmente al impedimento estérico del radical unido al nitrógeno para la asociación. Como es natural, las amidas terciarias (sin enlaces N—H) no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y de ebullición de acuerdo con su peso molecular.
A excepción de la amida más sencillas (la formamida), las amidas sencillas son todas sólidas y solubles en agua, sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes.
- Casi todas las amidas son incoloras e inodoras
- Son neutras frente a los indicadores
- Los puntos de fusión y ebullición de las amidas secundarias son bastante menores
Por su parte, las amidas terciarias no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y ebullición de acuerdo con su peso molecular
Tipos de Amidas
Existen tres tipos de amidas conocidas como primarias, secundarias y terciarias, dependiendo del grado de sustitución del átomo de nitrógeno; también se les llama amidas sencillas, sustituidas o disustituidas respectivamente.
Obtención
Las amidas pueden obtenerse a partir de halogenuros de alquilo por reacción con amoniaco, aminas primarias o secundarias, con lo que resultan amidas primarias, secundarias o terciarias, respectivamente. Por ejemplo:
CH3—CO—Cl + 2 CH3—NH2 = CH3—CO—NH—CH3 + CH3—NH3+ Cl-
cloruro de acetilo metilamina N-metilacetamida cloruro de metilamonio
Reacciones Químicas
Las reacciones químicas de las amidas son las generales de los derivados funcionales de ácidos carboxílicos, si bien son entre éstos, de los compuestos menos reactivos. Así, por ejemplo, la reacción de hidrólisis suele ser muy lenta, por lo que hay que llevarla a cabo calentando y en medios ácidos o básicos; su mecanismo es análogo al de la hidrólisis de los ésteres.
Por otra parte, las amidas tienen también algunas reacciones químicas parecidas a las de las aminas, siendo la más análoga la reacción con ácido nitroso, con el que los tres tipos de amidas se comportan igual que las aminas.
Entre las amidas merece citarse la carbodiamida o urea, que puede considerarse como la diamida del ácido carbónico:
urea
H2N-O-NH2
Es el producto de excreción nitrogenado más importante, tanto en el hombre como en los animales. Por otra parte, tiene también un gran interés técnico, por su utilización como abono, así como en la industria farmacéutica, y sobre todo para la fabricación de resinas y materiales plásticos.
Las amidas se pueden convertir directamente en ésteres por reacción de los alcoholes en medio ácido.
Las amidas primarias poseen reacciones especiales:
- Se pueden deshidratar por calefacción con pentóxido de fósforo (P2O2) formando nitrilo
- Reaccionan con el ácido nitroso, formando el ácido carboxílico y nitrógeno
- Las amidas se pueden hidrolizar (romper por acción del agua)
- Las amidas por hidrólisis ácida dan ácidos; por hidrólisis básica dan sales; con alcoholes producen ésteres; y por deshidratación producen nitrilos.
Aplicaciones
- Como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
- Además se usan como antitranspirantes y como neutralizantes.
- Otra aplicación es como dispersantes de jabones cálcicos.
- La Urea es uno de los compuestos más importantes relacionados con las amidas:NH2-O-NH2
La urea es un polvo blanco cristalino utilizado en plásticos y fertilizantes. Es un producto del metabolismo de las proteínas; se encuentra en altas concentraciones en la orina de los animales.
La síntesis de urea en un laboratorio fue el hecho que rompió con la idea de que solo se podía sintetizar compuestos orgánicos de forma natural. La producción de la urea ocurre en el organismo, mientras que a nivel industrial se obtiene por reacción de amoniaco y fosfeno.
Por otra parte, el Nylon también pertenece a la familia de las amidas y es considerada como una poliamida.
Estabilidad
Las amidas etoxiladas poseen buena estabilidad en productos cosméticos. Al igual que la mayor parte de las amidas, son sustancias más estables en medios ligeramente ácidos.
Precauciones
Estos tensioactivos son seguros para usos cosméticos.
Fuente
Química Orgánica