Calmodulina
| ||||||
Calmodulina. Es una proteína acídica intracelular, que se encuentra esencialmente en el cerebro y el corazón, es de bajo peso molecular y termoestable, además se expresa en todas las células eucariotas, siendo uno de los reguladores en la transducción de la señal de calcio en la célula.
Funciones
La mayor parte de las funciones reguladas por la calmodulina se realizan en el citoplasma mientras que el papel de esta proteína en el núcleo es prácticamente desconocido. Según estudios realizados indican que la calmodulina se une a un número elevado de proteínas implicadas en el splicing de los pre-mRNAs, lo que indica que una función importante de la calmodulina en el núcleo celular es la regulación de la maduración de los RNAs.
Otra de las funciones recientemente descubiertas es la relacionada con la motilidad espermática. Se ha localizado esta proteína en la cabeza de los espermatozoides lo cual sugiere su participación en la capacitación y reacción acrosómica. Está descrito que la fosforilación de proteínas es un proceso implicado en la regulación de la motilidad espermática y diferentes fosfoproteínas han sido asociadas con el inicio y mantenimiento de la misma. Los complejos CaM son capaces de regular el estado de fosforilación a través de la activación de la proteína fosfatasa del tipo 2ª calcineurina dependiente de ella.
Características
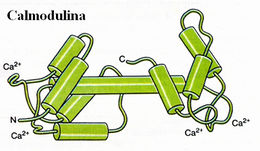
La calmodulina tiene de masa molecular 17.000 daltons, es una proteína acídida con cuatro sitios de unión al ion Ca de alta afinidad, se asocia a multitud de proteínas diferentes y, en su estado unido al ion Ca, modula sus actividades. Es una proteína formada por una cadena polipeptídica. Los dominios globulares N-terminal (azul) y C-terminal (rojo) están unidos por una hélice alfa (verde); cada uno de los dominios globulares contiene dos sitios de unión al ion calcio. Cuando la concentración de ion Ca aumenta a 1 µM, la unión de ion Ca a la calmodulina provoca un cambio de conformación. La unión de cuatro iones calcio induce cambios alostéricos en la proteína. El más notable es la rotación de los dos dominios globulares. Este cambio de conformación permite que la calmodulina se pueda unir a proteínas y de esta manera controlar su actividad
La conformación de la proteína unida al ion Ca le permite unirse a las proteínas diana, la calmodulina se asocia con un dominio helicoidal en rojo de uno de los muchos enzimas que regula. Así la larga hélice central de la calmodulina se ha doblado sobre sí misma al unirse al dominio helicoidal del sustrato
La calmodulina es una subunidad integral de la proteína quinasa dependiente de calcio/calmodulina (CaM quinasa). Cuando el ion Ca intracelular aumenta en respuesta a algunos estímulos, la calmodulina une ion Ca, experimentando un cambio de conformación que activa a la CaM quinasa al unirse al dominio helicoidal (rojo).
La calmodulina contiene 148 residuos de aminoácidos y cuatro dominios fijadores de Ca++, presenta como característica única que el residuo 115 es trimetilado y tiene un alto grado de conservación, ya que se le encuentra en las plantas así como en los animales.
Cuando la calmodulina capta al Ca++, se vuelve capaz de activar a cinco diferentes cinasas dependientes de calmodulina. Una de ellas es la quinasa de cadenas livianas de miosina, la cual fosforila a la miosina; esta lleva a cabo la contracción en el músculo liso. Otra es la fosforilasa quinasa, que activa la fosforilasa. Las Ca++/calmodulinquinasas I y II se ocupan de la función sináptica, y la Ca++ calmodulinquinasa III está relacionada con la síntesis de proteínas. Otra proteína activada por la calmodulina es la calcineurina, una fosfatasa que inactiva los conductos de calcio desfosforilándolos y también tienen una función en la activación de las células T, siendo inhibida por algunos inmunosupresores.
Mecanismo de acción
La calmodulina media procesos inflamatorios, metabólicos, el movimiento intracelular, la memoria a corto y a largo plazo, el crecimiento de células nerviosas y las respuestas inmunes. Ésta es expresada en multitud de tipos de células, presentando ubicaciones distintas entre las que se incluye el citoplasma, en el interior de los orgánulos o en las membranas que los recubren. Muchas de estas proteínas son incapaces de unirse con el calcio por sí mismas por lo que llevan incorporadas un sensor de calcio y un transductor de señal. Para unirse al calcio sufren un cambio conformacional, lo que permite conseguir una serie de proteínas específicas. Estas modificaciones son post transduccionales como la fosforilación, acetilación, y la metilación.