Catálisis
| ||||||||||
Catálisis se refiere a la aceleración de la tasa de un reacción química mediante una sustancia, llamada catalizador, que no es modificada por la reacción. La catálisis es crucial para cualquier forma de vida, ya que hace que las reacciones químicas ocurran mucho más rápido, a veces por un factor de varios millones de veces más de lo que sería "por sí mismas".
Sumario
Historia
Los catalizadores pueden actuar de dos maneras, la primera formando un compuesto intermedio y la segunda, absorción.
En un sentido general, cualquier cosa que aumenta la velocidad de un proceso es un "catalizador", un término derivado del griego, que significa "anular", o "desatar", o "recoger". La frase procesos catalizados fue acuñado por Jöns Jakob Berzelius en 1836 para describir las reacciones que son acelerados por sustancias que permanecen sin cambios después de la reacción. Otro de los primeros químicos involucrados en la catálisis fue Alexander Mitscherlich quien se refirió a los procesos de contacto y Johann Wolfgang Döbereiner que habló deacción de contacto y cuya encendedor basado en hidrógeno y una esponje de platino se convirtió en un gran éxito comercial en la década de 1820. Humphry Davy descubrió el uso de platino en la catálisis. En la década de 1880, Wilhelm Ostwald en la Universidad de Leipzig inició una investigación sistemática de las reacciones que eran catalizadas por la presencia de los ácidos y las bases, y encontró que las reacciones químicas ocurren a una velocidad finita y que estas velocidades pueden utilizarse para determinar la fuerza de ácidos y bases. Por este trabajo, Ostwald fue galardonado en 1909 con el Premio Nobel de Química.
Características
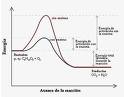
La característica general de la catálisis es que la reacción catalítica tiene un menor cambio de energía libre de la etapa limitante hasta el estado de transición que la reacción no catalizada correspondiente, resultando en una mayor velocidad de reacción a la misma temperatura. Sin embargo, el origen mecánico de la catálisis es complejo.
Los catalizadores pueden afectar favorablemente al entorno de reacción, por ejemplo, los catalizadores ácidos para las reacciones de los compuestos carbonílicos forman compuestos intermedios específicos que no se producen naturalmente, tales como los ésteres de Osmio en la dihidroxilación de alquenos catalizadas por el tetróxido de osmio, o hacer la ruptura de los reactivos a formas reactivas, como el hidrógeno atómico en la hidrogenación catalítica.
Cinéticamente, las reacciones catalíticas se comportan como las reacciones químicas típicas, es decir, la velocidad de reacción depende de la frecuencia de contacto de los reactivos en la etapa determinante de velocidad (ver ecuación de Arrhenius. Normalmente, el catalizador participa en esta etapa lenta, y las velocidades están limitadas por la cantidad de catalizador. En catálisis heterogénea, la difusión de los reactivos a la superficie de contacto y la difusión de los productos desde dicha superficie puede ser la etapa determinante de la velocidad. Eventos similares relacionados con la unión del sustrato y la disociación del producto se aplican en la catálisis homogénea.
Aunque los catalizadores no son consumidos por la propia reacción, pueden resultar inhibidos, desactivados o destruidos por procesos secundarios. En la catálisis heterogénea, procesos secundarios típicos incluyen el coqueo, donde el catalizador se cubre por productos secundarios poliméricos. Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o evaporase en un sistema sólido-gas.
Catálisis heterogénea
Los catalizadores heterogéneos son aquellos que actúan en una fase diferente que los reactivos. La mayoría de los catalizadores heterogéneos son sólidos que actúan sobre sustratos en una mezcla de reacción líquida o gaseosa. Se conocen diversos mecanismos para las reacciones en superficies, dependiendo de cómo se lleva a cabo la adsorción ( Langmuir-Hinshelwood, Eley -Rideal, y Mars-van Krevelen).8 El área superficial total del sólido tiene un efecto importante en la velocidad de reacción. Cuanto menor sea el tamaño de partícula del catalizador, mayor es el área superficial para una masa dada de partículas.
Por ejemplo, en el proceso de Haber, el hierro finamente dividido sirve como un catalizador para la síntesis de amoníaco a partir de nitrógeno e hidrógeno. Los gases reactantes se adsorben en los "sitios activos" de las partículas de hierro. Una vez adsorbidos, los enlaces dentro de las moléculas reaccionantes se resienten, y se forman nuevos enlaces entre los fragmentos generados, en parte debido a su proximidad. De esta manera el particularmente fuerte triple enlace en el nitrógeno se debilita y los átomos de hidrógeno y nitrógeno se combinan más rápido de lo que lo harían el caso en la fase gaseosa, por lo que la velocidad de reacción aumenta.
Los catalizadores heterogéneos suelen estar "soportados", que significa que el catalizador se encuentra disperso en un segundo material que mejora la eficacia o minimiza su costo. A veces el soporte es más que una superficie sobre la que se transmite el catalizador para aumentar el área superficial. Más a menudo, el soporte y el catalizador interactúan, afectando a la reacción catalítica.
Enzimas
Enzima (del griego, fermento) son moléculas de proteínas particulares cuya función es facilitar o acelerar la mayoría de las reacciones químicas de la célula.
Dentro de la células biológicas ocurren muchas reacciones químicas que, sin la presencia de las enzimas, ocurririan a una tasa demasiado lenta para ser biológicamente relevantes. Las enzimas pueden acoplar dos o más reacciones para que ocurran al mismo tiempo, de esta forma una reacción termodinámicamente favorable puede ser utilizada para "dirigir" una reacción desfavorable. Uno de los ejemplos más comunes son las enzimas que utilizan la desfosforilación del ATP para dirigir reacciones no relacionadas.
Enzimas alostéricas
Las enzimas con un comportamiento alostérico muestran una dependencia sigmoidal de la velocidad de reacción (V) en función de la concentración de sustrato [S].
El modelo de Michaelis-Menten ayudó mucho al desarrollo de la química de la enzimas gracias a su simplicidad y aplicabilidad. Sin embargo, este modelo no explica las propiedades cinéticas de muchas enzimas. Un grupo de enzimas que no obedecen la cinética de Michaelis-Menten son las enzimas alostéricas, estas enzimas tienen varias subunidades y varios sitios activos.
En las enzimas alostéricas la unión de un sustrato a un sitio activo puede afectar las propiedades de otros sitios activos en la misma molécula. Un posible resultado de esta interacción entre subunidades es que la unión del sustrato resulte cooperativo, es decir que la unión del sustrato en un sitio activo facilita la unión de los otros sustratos en los sitios activos vecinos. Además la actividad de una enzima alostérica puede ser alterada por moléculas regulatorias que se unan de manera reversible sitios sobre la proteína que se encuentren en sitios diferentes al sitio activos. Así, las propiedades catalíticas de las enzimas alostéricas pueden ajustarse para cumplir con las demandas inmediatas de la célula. Debido a ello las enzimas alostéricas son los puntos clave de regulación de las vías metabólicas.
Inhibición Enzimática
La actividad de muchas enzimas puede ser inhibida por pequeñas moléculas específicas o iones. La inhibición de las enzimas es utilizada por la célula para controlar la actividad metabólica. La enzimas alostéricas son un punto de control muy utilizado y es habitual que varios metabolitos diferentes actuen sobre ellas, tanto inhibiendo como activando. Además muchas drogas y toxinas son inhibidores de enzimas claves para el metabolismo celular. En el estudio de los mecanismos de acción de las enzimas es muy útil contar con inhibidores específicos que permiten determinar cuales son las funciones donde actúa la enzima y/o los aminoácidos relevantes para su actividad catalítica.
Catalizadores homogéneos
Normalmente los catalizadores homogéneos están disueltos en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia de H+ en la esterificación de los ésteres, por ejemplo, acetato de metilo a partir del ácido acético y el metanol.9 Para los químicos inorgánicos, la catálisis homogénea es a menudo sinónimo de catalizadores organometálicos.
Importancia de la catálisis
Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de su fabricación.11 En 2005, los procesos catalíticos generaron cerca de 900.000 millones de dólares en productos de todo el mundo. (pdf) La catálisis es tan penetrante que las subáreas no son fácilmente clasificables.
Algunas áreas de particular concentración se estudian más adelante.
Fuente
- KARAPETIANS,M.J.y S.I.DRAKIN: Estructura de la sustancia. Editorial Mir, Moscú, 1974.