Cloruro de Níquel
| ||||||||
Cloruro de níquel
El cloruro de níquel (II) es el compuesto químico NiCl2. La sal anhidra es amarilla, pero el hidrato más conocido es el NiCl2-6H2O es verde. Muy raras veces se le encuentran en la naturaleza como nickelbischofite mineral. Existe también un dihidrato. En general el cloruro de níquel (II), es la fuente más importante de níquel para la síntesis química. Las sales de níquel son carcinogénicas. Las sales también son delicuescentes, en cuanto a que absorben humedad del aire para formar una solución.
Sumario
Producción y síntesis
La producción a gran escala de cloruro de níquel implica la extracción con ácido clorhídrico de matte de níquel y los residuos obtenidos de tostación de mineral de refinación de níquel.
Rara vez se prepara NiCl2-6H2O en el laboratorio porque es barato y tiene una larga vida útil. El hidrato se puede convertir a la forma anhidra mediante calentamiento en cloruro de tionilo o por calentamiento en una corriente de HCl gaseoso. El calentamiento simple de los hidratos no produce el dicloruro anhidro.
NiCl2-6H2O + 6 SOCl2→NiCl2 + 6 SO2 + 12 HCl
La deshidratación es acompañada por un cambio de color del verde al amarillo.
Estructura y propiedades
El NiCl2 adopta la estructura CdCl2. En este arreglo, cada centro Ni2+ se encuentra coordinado con seis centros Cl- y cada cloro se encuentra conectado con tres centros Ni (II).
En el NiCl2 las uniones Ni-Cl son de "carácter iónicas". Por el contrario el NiCl2-6H2O se compone de moléculas trans separadas - [NiCl2 (H2O)4] ligadas más débilmente a las moléculas de agua adyacentes. Es de notar que sólo cuatro de las seis moléculas de agua en la fórmula están unidas al níquel, y los dos restantes son agua de cristalización. El hexahidrato de cloruro de cobalto (II) tiene un estructura similar.
Muchos compuestos de níquel (II) son paramagnéticos, debido a la presencia de dos electrones no apareados en cada centro metálico. Sin embargo los complejo de níquel cuadrados planos, son diamagnéticos.
Las soluciones de cloruro de Níquel (II) son ácidas, con un pH cercano a 4 debido a la hidrólisis del ion del Ni +2.
Coordinación química
 Color de diversas concentraciones de Ni (II) en solución acuosa. De izquierda a derecha, [Ni (NH3)6] 2 +, [Ni (etilendiamina es )3] 2 +, [NiCl4] 2 - , [Ni(H2O)6] 2 +
Color de diversas concentraciones de Ni (II) en solución acuosa. De izquierda a derecha, [Ni (NH3)6] 2 +, [Ni (etilendiamina es )3] 2 +, [NiCl4] 2 - , [Ni(H2O)6] 2 +
La mayoría de las reacciones atribuidas al "cloruro de níquel" implican el hexahidrato, aunque las reacciones especializadas requieren la forma anhidra.
Se pueden utilizar reacciones a partir de NiCl2-6H2O para formar una variedad de complejos de coordinación de níquel porque los ligandos de H2O son rápidamente desplazadas por amoníaco, aminas, tioéteres, tiolatos, y fosfinas. En algunos derivados, el cloruro se mantiene dentro de la esfera de coordinación, mientras que el cloruro es desplazado por ligandos altamente básicos. Algunos ejemplos de complejos son:
Algunos complejos de cloruro de níquel existen como una mezcla en equilibrio de dos geometrías; estos ejemplos son algunos de los ejemplos más dramáticos de isomería estructural para un determinado número de coordinación. Por ejemplo, el NiCl2(PPh3)2, que contiene cuatro coordenadas de Ni (II), existe en solución como una mezcla de los isómeros diamagnético cuadrado plano y paramagnéticos tetraédricos. Complejos cuadrados planos de níquel a menudo pueden formar aductos de cinco coordenadas.
El NiCl2 es el precursor de los complejos acetilacetonato de Ni(acac)2 (H2O)2 y el (Ni (acac)2)3 soluble en benceno, que es un precursor del Ni(1,5-ciclooctadieno)2, un reactivo importante en química orgánica del níquel.
En presencia de captadores de agua, el cloruro de níquel hidratado (II) reacciona con el dimetoxietano (DME) para formar el complejo molecular NiCl2(DME)2. Los ligandos de DME en este complejo son lábiles. Por ejemplo, este complejo reacciona con el complejo sódico ciclopentadienuro para dar el compuesto sándwich niqueloceno.
Aplicaciones en síntesis orgánica
El NiCl2 y su hidrato son en ocasiones útiles en síntesis orgánica.
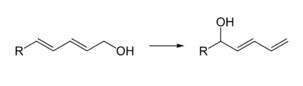
- Como un ácido de Lewis leve, por ejemplo, para la isomerización regioselectiva de dienoles:
- En combinación con CrCl2 para el acoplamiento de un aldehído y un yoduro vinílico para dar alcoholes alílicos.
- Para las reducciones selectivas en presencia de LiAlH4, por ejemplo, para la conversión de alquenos a alcanos.
- Como un precursor del boruro de níquel, preparado in situ a partir NiCl2. Este reactivo se comporta como níquel Raney, que comprende un sistema eficiente para la hidrogenación de compuestos de carbonilo no saturados.
- Como precursor de Ni finamente dividido por reducción con Zn, para la reducción de aldehídos, alquenos, y los compuestos nitro aromáticos. Este reactivo también promueve el reacciones de homo-acoplamiento, es decir 2RX→R-R donde R = vinilo, arilo.
- Como un catalizador para hacer arylfosfonatos dialquilo de fosfitos y arilo yoduro, Ari:
Ari + P (OEt)3→ARP (O) (OEt) 2 + EtI
Otros usos
Soluciones de cloruro de níquel se utilizan para galvanoplastia de níquel en productos metálicos.
Seguridad
Níquel (II) cloruro es irritante tras la ingestión, inhalación, contacto con la piel y los ojos. La exposición prolongada al níquel y sus compuestos se ha demostrado que producen cáncer.
Referencias
- Gill, N. S. and Taylor, F. B. (1967). "Tetrahalo Complexes of Dipositive Metals in the First Transition Series". Inorganic Syntheses 9: pp. 136-142.
- G. D. Stucky, J. B. (1967). "The Crystal and Molecular Structure of Tetraethylammonium Tetrachloronickelate(II)". Acta Crystallographica 23 (6): pp. 1064-1070.
- Pray, A. P. (1990). "Anhydrous Metal Chlorides". Inorganic Syntheses 28: pp. 321-Tien-Yau Luh, Yu-Tsai Hsieh Nickel(II) Chloride" in Encyclopedia of Reagents for Organic Synthesis (L. A. Paquette, Ed.) 2001 J. Wiley & Sons, New York. doi 10.1002/047084289X.rn012. Article Online Posting Date: April 15, 2001.
- Wells, A. F. Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.