Coordenadas termodinámicas
| ||||||
Coordenadas termodinámicas. Son las coordenadas macroscópicas que reflejan el estado interno de un sistema termodinámico y mediante las cuales se puede determinar su energía interna (por ejemplo Presión y temperatura). Los valores de las coordenadas termodinámicas dependen del estado en que se encuentra el sistema.
Sumario
Variables en un sistema de Coordenadas Termodinámicas
En un sistema se definen las variables empíricas usadas para definir o dar a conocer un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, coordenadas en el plano x , y) y no son dependientes del tiempo. A dichas variables empíricas (experimentales) de un sistema se las conoce como coordenadas térmicas y dinámicas del sistema
Aplicación del concepto de Coordenadas Termodinámicas
La termodinámica hace uso de las coordenadas termodinámicas para estudiar desde el punto de vista macroscópico los sistemas. Por ejemplo para el análisis y estudio de fenómenos como la expansión de un gas dentro de un recipiente que puede variar su volumen. Entre estas coordenadas podemos citar la temperatura, que proporciona la energía cinética promedio del movimiento desordenado de las moléculas y la presión, que es proporcional a la variación de la cantidad de movimiento de las moléculas debido a los choques.
En general, la Termodinámica estudia, desde el punto de vista macroscópico, los intercambios de energía de los sistemas con los alrededores, pero teniendo en cuenta las variaciones que experimenta la energía interna.
Un sistema termodinámico se caracteriza por sus propiedades, relacionadas entre sí mediante las ecuaciones de estado. Éstas se pueden combinar para expresar la energía interna y los potenciales termodinámicos, útiles para determinar las condiciones de equilibrio entre sistemas y los procesos espontáneos.
Primera ley de la termodinámica
También conocido como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.Esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Antoine Lavoisier.
Segunda ley de la termodinámica
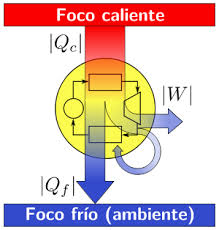
Esta ley regula la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario; establece la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas.
Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía tal que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero. Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos a temperatura más alta a aquellos de temperatura más baja.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
Enunciado de Clausius
"No es posible ningún proceso cuyo único resultado sea la extracción de calor de un recipiente a una cierta temperatura y la absorción de una cantidad igual de calor por un recipiente a temperatura más elevada".
Enunciado de Kelvin
No existe ningún dispositivo que absorba calor de una única fuente y lo convierta íntegramente en trabajo.
Enunciado de Kelvin—Planck
Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito, y la realización de una cantidad igual de trabajo.
Otra interpretación
Es imposible construir una máquina térmica cíclica que transforme calor en trabajo sin aumentar la energía termodinámica del ambiente. Debido a esto podemos concluir, que el rendimiento energético de una máquina térmica cíclica que convierte calor en trabajo, siempre será menor a la unidad, y ésta estará más próxima a la unidad, cuanto mayor sea el rendimiento energético de la misma. Es decir, cuanto mayor sea el rendimiento energético de una máquina térmica, menor será el impacto en el ambiente, y viceversa.
Tercera ley de la termodinámica
Afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto.
Ley cero de la termodinámica
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, entre otras) no son dependientes del tiempo. A dichas variables empíricas (experimentales) de un sistema se les conoce como coordenadas termodinámicas del sistema.
A este principio se le llama del equilibrio termodinámico. Si dos sistemas A y B están en equilibrio termodinámico, y B está en equilibrio termodinámico con un tercer sistema C, entonces A y C están a su vez en equilibrio termodinámico. Este principio es fundamental, aun siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibe la posición 0.
Coordenadas termodinámicas para estudios reales
En el estudio del fenómeno de expansión de un gas, producto de una alta presión, al expandirse el gas contra el pistón que puede deslizarse por el cilindro cerrado en el otro extremo, se obtiene trabajo mecánico (la rueda gira). Si no existe otro tipo de intercambio de energía con el medio, el trabajo realizado por el gas es a expensas de una disminución de su energía interna, reflejada en los valores de dichas coordenadas.
Enlace externo
Fuente
- Colectivo de autores, Fundamentos Físicos de la Termodinámica, Ed. Pueblo y Educación, 1986.