Diferencia entre revisiones de «Electrólisis»
(→Electrólisis) |
|||
| Línea 1: | Línea 1: | ||
{{Definición | {{Definición | ||
| − | |nombre= | + | |nombre=Electrólisis |
| − | |imagen= | + | |imagen=Electrolisis.JPG |
|tamaño= | |tamaño= | ||
| − | |concepto= | + | |concepto=Descomposición de algunas sustancias al paso de la corriente eléctrica a través de ellas. |
| − | }} | + | }} |
| − | + | '''Electrólisis''' o '''Electrolisis''' proceso que separa los elementos de un compuesto por medio de la electricidad. Ciertas sustancias, ([[Ácidos|ácidos]], hidróxidos, sales y algunos [[Óxidos metálicos|óxidos metálicos]] disueltos o fundidos) son conductores de electricidad al mismo tiempo que se descomponen al paso de la corriente eléctrica, a estas sustancias se les llama electrolitos. A tal fenómeno se le denomina electrólisis y constituye fundamentalmente un proceso de oxidación reducción que se desarrolla "no espontáneamente" es decir, un conjunto de transformaciones que implican un aumento de energía libre del sistema, y por ende, requiere para su realización el concurso de una fuerza externa de energía. | |
| − | + | Al igual que en las [[Pila eléctrica|pilas electroquímicas]], una reacción de electrólisis puede ser considerada como el conjunto de dos medias reacciones, una oxidación anódica y una reducción catódica. | |
| + | Cuando conectamos los electrodos con una fuente de energía (generador de corriente directa), el electrodo que se une al borne positivo del generador es el ánodo de la electrólisis y el electrodo que se une al borne negativo del generador es el cátodo.<br> | ||
| − | + | == Electrólisis. == | |
| − | + | [[Image:Electrolisis.gif|thumb|right|300px]] | |
| + | Las [[Reacciones de oxidación reducción|reacciones]] que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en la [[Pila eléctrica|pila]], la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones [[Cloro]] (Cl) , pues el [[Sodio]] (Na) solo puede reducirse. <br> | ||
| − | + | == Electrólisis de disoluciones acuosas<br> == | |
| − | + | Cuando se trata de electrólisis de [[Disoluciones acuosas|disoluciones acuosas]] de diversos electrolitos, las reacciones que tienen lugar en el ánodo deben escogerse de acuerdo con los principios energéticos a que nos hemos referido antes, pues existe más de una oxidación posible en el ánodo más de una reducción posible en el cátodo, debido a que además de las especies iónicas producidas por los electrolitos están presentes las moléculas de [[agua]] y la misma puede puede oxidarse y reducirse de forma similar a la sales. | |
| − | + | Por ejemplo durante la electrólisis de la solución de Sulfuro de [[cobre]] (CuSO<sub>4</sub>) (con electrodos de platino liso) sobre el cátodo se observa la separación del cobre metálico. En cambio sobre el ánodo dejan su carga las moléculas de agua y no los iones de Sulfuro (SO<sub>4</sub>) .<br> | |
| − | == | + | == El esquema de la electrólisis es como sigue:<br> == |
| − | + | *Sobre el [[Cátodo|cátodo]](-): 2Cu + 4e 2Cu | |
| + | *Sobre el ánodo(+): 3H<sub>2</sub>O 2H<sub>3</sub>O + 1/2O2 + 2e | ||
| − | + | Sobre el ánodo en este caso se separa el oxígeno, que se elimina como gas, y en la solución, en las proximidades del ánodo, se acumulan los iones [[hidrógeno]] (H) , que pueden estar presentes solo con una cantidad equivalente de algunos aniones. tales aniones son sulfuros (SO<sub>4</sub>) , que se desplazan durante la electrólisis hacia el ánodo y se acumulan en las proximidades de este junto con los iones [[hidrógeno]] (H). Por consiguiente, junto al ánodo, además del oxígeno se forma también el ácido sulfúrico (como iones correspondientes), es decir la solución se acidifica.<br> | |
| − | + | == Disoluciones acuosas<br> == | |
| − | + | En general en el caso de disoluciones acuosas, debe tenerse presente que las moléculas de agua pueden oxidarse o reducirse de acuerdo con las siguientes ecuaciones:<br>[[Reacciones de oxidación reducción|Oxidación]]: 3 H<sub>2</sub>O 2H<sub>3</sub>O + 1/2 O2 + 2e E0 = 1.23V <br>[[Fórmulas de Reducción|Reducción]]: H<sub>2</sub>O + 1e 1/2 H<sub>2</sub> + OH E = - 0.82 V (a pH = 7)<br>Note que en aquellos casos en que las disoluciones tienen un pH diferente de cero (como esta segunda) los potenciales ya no son llamados E0 sino que han varíado de acuerdo con los valores de (H<sub>3</sub>O) y (OH) y deben ajustarse con la conocida ecuación de Nernst.<br> | |
| − | == | + | == Electrólisis y otros procesos de oxidación-reducción<br> == |
| − | + | En las [[Electrólisis|electrólisis]] pueden tener lugar también otros procesos de oxidación-reducción sin que sobre el electrodo se deposite la fase sólida; así, los iones [[Hierro]] (Fe) e yodo (I) se oxidan a [[Hierro]] (Fe) e yodo (I<sub>2</sub>), mientras que los [[Hierro]] (Fe) e yodo (I<sub>2</sub>) se reducen sobre el cátodo a [[Hierro]] (Fe) e yodo (I) , etc.<br>Si el ánodo no es de platino, sino de cualquier otro metal, también puede participar en los procesos de oxidación reducción, que tienen lugar durante la electrólisis. Así, se había visto que durante la electrólisis de la solución Sulfuro de Cobre (CuSO,<sub>4</sub>), utilizando un ánodo de platino, las moléculas de agua se oxidan sobre el mismo a [[Oxígeno]] (O<sub>2</sub>). Si el ánodo de platino se sustituye por uno de cobre, sobre el mismo, durante la electrólisis, no se oxidaran ya las moléculas de agua, sino el material del propio electrodo, es decir cobre metálico, que pierde electrones más fácilmente todavía que las moléculas de agua. En consecuencia, el ánodo se disolverá con la formación de los iones [[Cobre]] (Cu):<br>Cu - 2e Cu <br>Simultáneamente, sobre el cátodo se depositará una cantidad equivalente de cobre. En otras palabras tendrá lugar una especie de paso de cobre del ánodo al cátodo. <br> | |
| − | == | + | == Potencial de descomposición:<br> == |
| − | + | Consideremos como ejemplo la electrólisis de la solución de Sulfuro de cobre (CuSO<sub>4</sub>) con electrodos de platino. Al pasar la corriente eléctrica por la solución, en los electrodos se liberan productos de la electrólisis, que estando presentes simultáneamente con los iones que les han dado origen, forman pares de oxidación-reducción. En el ejemplo en el cátodo se forma el par Cu /Cu y en el ánodo, O<sub>2</sub> + H / H<sub>2</sub>O. Tan pronto comienza a fluir la corriente, la liberación de O<sub>2</sub> en el ánodo y la deposición de Cu en el cátodo convierten el aparato en una celda galvánica: Pt / Cu / Cu2+, H+ / O<sub>2</sub> / Pt que tiene su propia fuerza electromotriz (FEM). La dirección de esta F.E.M es contraria a la de la F.E.M externa, que se aplica en la electrólisis. El funcionamiento de la celda trata de que la corriente fluya en dirección opuesta a la corriente con la que se intenta realizar la electrólisis de la disolución. Para poder contrarrestar esta " fem de oposición", la FEM aplicada deber ser mayor que la de la celda cuya reacción es opuesta a la reacción de la electrólisis deseada.<br>La tensión mínima que es necesario aplicar a los electrodos para provocar la electrólisis continua del electrolito dado, se denomina Potencial de Descomposición (Ed). <br> | |
| − | [[Category:Química]] [[Category:Química_física]] [[Category:Electrolitos]] | + | == El potencial de descomposición se calcula como:<br> == |
| + | |||
| + | Ed = Ec - Ea (1)<br>donde: <br>Ea = potencial del par que se verifica en el ánodo.<br>Ec = potencial del par que se verifica en el cátodo. | ||
| + | |||
| + | Sin embargo, frecuentemente es necesario aumentar la fem hasta un punto considerablemente superior a este valor para poder provocar la reacción con una velocidad apreciable. Este exceso de potencial se llama sobrevoltaje y depende de la naturaleza de los electrodos, de la corriente por unidad de área y de la composición de la solución. | ||
| + | |||
| + | [[Polarización|Polarización]] por concentración y sobrevoltaje o sobretensión. <br>En un electrodo que se encuentra en estado de equilibrio la descarga de iones y su formación tienen lugar a la misma velocidad al mismo tiempo que la corriente neta que circula es cero. No obstante, si como resultado de la aplicación de una FEM exterior hay un paso real de corriente, el electrodo resultará perturbado de su condición de equilibrio. Esta perturbación del equilibrio asociada con el flujo de corriente se denomina polarización electrolítica y resulta de la lentitud de alguno de los procesos que tienen lugar en los electrodos durante la descarga o formación de un ión. La polarización se clasifica en dependencia del paso que controla la cinética del proceso electroquímico, esta puede clasificarse como polarización por difusión, polarización por transferencia, por reacción química, entre otras. Las más frecuentes son las dos primeras. | ||
| + | |||
| + | Un tipo sencillo de polarización que se debe esencialmente a la lentitud de la difusión de los iones en la disolución que resulta de las variaciones de concentración que tienen lugar en las proximidades de un electrodo durante la electrolisis; ésta se conoce como polarización por difusión. <br> | ||
| + | |||
| + | == La polarización por difusión<br> == | ||
| + | |||
| + | La [[Polarización por difusión|polarización por difusión]] en las proximidades del ánodo donde la concentración de iones aumenta por la oxidación del mismo el potencial práctico debe ser mayor que el potencial teórico. Por otra parte en las proximidades del cátodo donde ocurre la reducción existe menor concentración de iones y por tanto el potencial práctico en este electrodo es inferior al potencial teórico del mismo. se denota con la letra P. | ||
| + | |||
| + | En la electrólisis estudiada el valor de la polarización para el ánodo se designa como Pa-Cu, y para el cátodo lo denotamos como Pc-Cu (Estos se determinan experimentalmente porque dependen de la densidad de la corriente, de la naturaleza del metal empleado como electrodo, del estado la superficie del electrodo, de la temperatura y de la composición del medio), luego el cálculo de los potenciales reales para cada electrodo quedaría como:<br>Ea = E0 + Pa-Cu<br>Ec = E0 - Pc-Cu <br>En ocaciones la magnitud del potencial de descomposición Ed encontrada por la fórmula (1) resulta menor que la encontrada experimentalmente por otras razones que no son precisamente los fenómenos de polarización por difusión. La causa de ello radica en que al calcular Ed no se ha tenido en cuenta otro tipo de polarización conocida como polarización por activación. | ||
| + | |||
| + | Si durante la electrólisis ocurre un desprendimiento gaseoso como es el caso de la oxidación, y/o reducción del agua: 2H /H<sub>2</sub>, O<sub>2</sub> + 4H / 2H<sub>2</sub>O, o cualquier otro gas como Cl<sub>2</sub>/2Cl ,etc., se producen condiciones diferentes a las que se crean al determinar sus potenciales normales. En efecto, al determinar los potenciales normales, como electrodo se emplea siempre una placa platinada de platino (es decir recubierta de una capa de negro de platino). Durante la electrolisis el desprendimiento de gas se produce sobre la superficie de una placa (o almbre) de platino lisa (brillante).<br> | ||
| + | |||
| + | == Cambio de condiciones de transformación<br> == | ||
| + | |||
| + | Experimentalmente se ha demostrado que este cambio de condiciones de transformación de H en [[Hidrógeno|hidrógeno]] elemental o del agua, en oxígeno elemental y H , conduce a la variación de los potenciales de los pares correspondientes. Por ejemplo, mientras que el potencial normal del par 2H /H<sub>2</sub> en el platino platinado es igual (por escala de hidrógeno) a cero, a la misma concentración de iones H y a presión del hidrógeno gaseoso sobre el electrodo de platino liso, es igual a -0.07 V. Del mismo modo, el potencial de este par cambia también al emplear electrodos de otros metales, por ejemplo, de [[cobre]], de plomo, mercurio, etc.<br>Semejante cambio de potencial del par dado, al sustituir el electrodo platinado por algún otro electrodo, se denomina sobre-tensión del elemento correspondiente (hidrógeno, oxígeno, cloro, etc) en el electrodo dado.<br> | ||
| + | |||
| + | == La sobre-tensión depende de distintas magnitudes<br> == | ||
| + | |||
| + | La sobre-tensión depende de distintas magnitudes: de al densidad de la corriente, de la naturaleza del metal empleado como electrodo, del estado la superficie del electrodo y de la temperatura. Por ejemplo la sobre-tensión del Hidrógeno en el cobre constituye - 0.85 V a una densidad de corriente de 0.1 A/cm , mientras que a 0.01A/cm es igual a -0.58 V.<br>Si se toma en consideración la existencia de sobre-tensión, calculando el potencial de descomposición, se debe tener en cuenta no solo las magnitudes de los potenciales de oxidación reducción de los pares que se forman en en el ánodo (Ea) y en el cátodo (Ec), sino también las sobre-tensiones correspondientes en los electrodos indicados ( a y c). La formula para calcular el potencial de descomposición toma el aspecto siguiente: <br>Ed = (Ec - c) - (Ea + a) (2)<br> | ||
| + | |||
| + | == Reglas para escoger las reacciones anódicas y catódicas<br> == | ||
| + | |||
| + | Las reglas que se aplican para escoger las reacciones anódicas y catódicas luego de haber tenido en cuenta los efectos de polarización electroquímica y sobrevoltaje en los ajustes de potencial serán: | ||
| + | # En el ánodo se escoge la oxidación más probable, o sea, la de potencial mas elevado. | ||
| + | # En el cátodo se escoge la reducción mas probable, o sea la, de potencial de oxidación mas bajo.<br> | ||
| + | |||
| + | == Fuentes == | ||
| + | |||
| + | *http://www.fq.uh.cu/dpto/qf/uclv/infoLab/practics/practicas/Electrolisis/teoria.htm | ||
| + | *http://redox.rimed.cu/module/biblioteca/datos_esp.php?pag=glo&num=172&Tip=ssb&idMod=7 | ||
| + | *http://www.fq.uh.cu/dpto/qf/uclv/infoLab/practics/practicas/Electrolisis/celdas/electroq1.pdf | ||
| + | *http://www.bvscuba.sld.cu/php/decsws.php?tree_id=SP4.011.097.057&lang=es&PHPSESSID=bdf74369ae9f5ffa64030a68e52942ce | ||
| + | *http://www.fq.uh.cu/dpto/qi/pag/tabla%20periodica/los%20elementos%20quimicos.htm | ||
| + | |||
| + | [[Category:Física]] [[Category:Química]][[Category:Química]] [[Category:Química_física]] [[Category:Electrolitos]] | ||
Revisión del 11:24 14 nov 2011
| ||||||
Electrólisis o Electrolisis proceso que separa los elementos de un compuesto por medio de la electricidad. Ciertas sustancias, (ácidos, hidróxidos, sales y algunos óxidos metálicos disueltos o fundidos) son conductores de electricidad al mismo tiempo que se descomponen al paso de la corriente eléctrica, a estas sustancias se les llama electrolitos. A tal fenómeno se le denomina electrólisis y constituye fundamentalmente un proceso de oxidación reducción que se desarrolla "no espontáneamente" es decir, un conjunto de transformaciones que implican un aumento de energía libre del sistema, y por ende, requiere para su realización el concurso de una fuerza externa de energía.
Al igual que en las pilas electroquímicas, una reacción de electrólisis puede ser considerada como el conjunto de dos medias reacciones, una oxidación anódica y una reducción catódica.
Cuando conectamos los electrodos con una fuente de energía (generador de corriente directa), el electrodo que se une al borne positivo del generador es el ánodo de la electrólisis y el electrodo que se une al borne negativo del generador es el cátodo.
Sumario
- 1 Electrólisis.
- 2 Electrólisis de disoluciones acuosas
- 3 El esquema de la electrólisis es como sigue:
- 4 Disoluciones acuosas
- 5 Electrólisis y otros procesos de oxidación-reducción
- 6 Potencial de descomposición:
- 7 El potencial de descomposición se calcula como:
- 8 La polarización por difusión
- 9 Cambio de condiciones de transformación
- 10 La sobre-tensión depende de distintas magnitudes
- 11 Reglas para escoger las reacciones anódicas y catódicas
- 12 Fuentes
Electrólisis.
Las reacciones que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en la pila, la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones Cloro (Cl) , pues el Sodio (Na) solo puede reducirse.
Electrólisis de disoluciones acuosas
Cuando se trata de electrólisis de disoluciones acuosas de diversos electrolitos, las reacciones que tienen lugar en el ánodo deben escogerse de acuerdo con los principios energéticos a que nos hemos referido antes, pues existe más de una oxidación posible en el ánodo más de una reducción posible en el cátodo, debido a que además de las especies iónicas producidas por los electrolitos están presentes las moléculas de agua y la misma puede puede oxidarse y reducirse de forma similar a la sales.
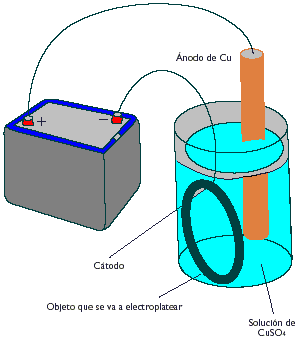
Por ejemplo durante la electrólisis de la solución de Sulfuro de cobre (CuSO4) (con electrodos de platino liso) sobre el cátodo se observa la separación del cobre metálico. En cambio sobre el ánodo dejan su carga las moléculas de agua y no los iones de Sulfuro (SO4) .
El esquema de la electrólisis es como sigue:
- Sobre el cátodo(-): 2Cu + 4e 2Cu
- Sobre el ánodo(+): 3H2O 2H3O + 1/2O2 + 2e
Sobre el ánodo en este caso se separa el oxígeno, que se elimina como gas, y en la solución, en las proximidades del ánodo, se acumulan los iones hidrógeno (H) , que pueden estar presentes solo con una cantidad equivalente de algunos aniones. tales aniones son sulfuros (SO4) , que se desplazan durante la electrólisis hacia el ánodo y se acumulan en las proximidades de este junto con los iones hidrógeno (H). Por consiguiente, junto al ánodo, además del oxígeno se forma también el ácido sulfúrico (como iones correspondientes), es decir la solución se acidifica.
Disoluciones acuosas
En general en el caso de disoluciones acuosas, debe tenerse presente que las moléculas de agua pueden oxidarse o reducirse de acuerdo con las siguientes ecuaciones:
Oxidación: 3 H2O 2H3O + 1/2 O2 + 2e E0 = 1.23V
Reducción: H2O + 1e 1/2 H2 + OH E = - 0.82 V (a pH = 7)
Note que en aquellos casos en que las disoluciones tienen un pH diferente de cero (como esta segunda) los potenciales ya no son llamados E0 sino que han varíado de acuerdo con los valores de (H3O) y (OH) y deben ajustarse con la conocida ecuación de Nernst.
Electrólisis y otros procesos de oxidación-reducción
En las electrólisis pueden tener lugar también otros procesos de oxidación-reducción sin que sobre el electrodo se deposite la fase sólida; así, los iones Hierro (Fe) e yodo (I) se oxidan a Hierro (Fe) e yodo (I2), mientras que los Hierro (Fe) e yodo (I2) se reducen sobre el cátodo a Hierro (Fe) e yodo (I) , etc.
Si el ánodo no es de platino, sino de cualquier otro metal, también puede participar en los procesos de oxidación reducción, que tienen lugar durante la electrólisis. Así, se había visto que durante la electrólisis de la solución Sulfuro de Cobre (CuSO,4), utilizando un ánodo de platino, las moléculas de agua se oxidan sobre el mismo a Oxígeno (O2). Si el ánodo de platino se sustituye por uno de cobre, sobre el mismo, durante la electrólisis, no se oxidaran ya las moléculas de agua, sino el material del propio electrodo, es decir cobre metálico, que pierde electrones más fácilmente todavía que las moléculas de agua. En consecuencia, el ánodo se disolverá con la formación de los iones Cobre (Cu):
Cu - 2e Cu
Simultáneamente, sobre el cátodo se depositará una cantidad equivalente de cobre. En otras palabras tendrá lugar una especie de paso de cobre del ánodo al cátodo.
Potencial de descomposición:
Consideremos como ejemplo la electrólisis de la solución de Sulfuro de cobre (CuSO4) con electrodos de platino. Al pasar la corriente eléctrica por la solución, en los electrodos se liberan productos de la electrólisis, que estando presentes simultáneamente con los iones que les han dado origen, forman pares de oxidación-reducción. En el ejemplo en el cátodo se forma el par Cu /Cu y en el ánodo, O2 + H / H2O. Tan pronto comienza a fluir la corriente, la liberación de O2 en el ánodo y la deposición de Cu en el cátodo convierten el aparato en una celda galvánica: Pt / Cu / Cu2+, H+ / O2 / Pt que tiene su propia fuerza electromotriz (FEM). La dirección de esta F.E.M es contraria a la de la F.E.M externa, que se aplica en la electrólisis. El funcionamiento de la celda trata de que la corriente fluya en dirección opuesta a la corriente con la que se intenta realizar la electrólisis de la disolución. Para poder contrarrestar esta " fem de oposición", la FEM aplicada deber ser mayor que la de la celda cuya reacción es opuesta a la reacción de la electrólisis deseada.
La tensión mínima que es necesario aplicar a los electrodos para provocar la electrólisis continua del electrolito dado, se denomina Potencial de Descomposición (Ed).
El potencial de descomposición se calcula como:
Ed = Ec - Ea (1)
donde:
Ea = potencial del par que se verifica en el ánodo.
Ec = potencial del par que se verifica en el cátodo.
Sin embargo, frecuentemente es necesario aumentar la fem hasta un punto considerablemente superior a este valor para poder provocar la reacción con una velocidad apreciable. Este exceso de potencial se llama sobrevoltaje y depende de la naturaleza de los electrodos, de la corriente por unidad de área y de la composición de la solución.
Polarización por concentración y sobrevoltaje o sobretensión.
En un electrodo que se encuentra en estado de equilibrio la descarga de iones y su formación tienen lugar a la misma velocidad al mismo tiempo que la corriente neta que circula es cero. No obstante, si como resultado de la aplicación de una FEM exterior hay un paso real de corriente, el electrodo resultará perturbado de su condición de equilibrio. Esta perturbación del equilibrio asociada con el flujo de corriente se denomina polarización electrolítica y resulta de la lentitud de alguno de los procesos que tienen lugar en los electrodos durante la descarga o formación de un ión. La polarización se clasifica en dependencia del paso que controla la cinética del proceso electroquímico, esta puede clasificarse como polarización por difusión, polarización por transferencia, por reacción química, entre otras. Las más frecuentes son las dos primeras.
Un tipo sencillo de polarización que se debe esencialmente a la lentitud de la difusión de los iones en la disolución que resulta de las variaciones de concentración que tienen lugar en las proximidades de un electrodo durante la electrolisis; ésta se conoce como polarización por difusión.
La polarización por difusión
La polarización por difusión en las proximidades del ánodo donde la concentración de iones aumenta por la oxidación del mismo el potencial práctico debe ser mayor que el potencial teórico. Por otra parte en las proximidades del cátodo donde ocurre la reducción existe menor concentración de iones y por tanto el potencial práctico en este electrodo es inferior al potencial teórico del mismo. se denota con la letra P.
En la electrólisis estudiada el valor de la polarización para el ánodo se designa como Pa-Cu, y para el cátodo lo denotamos como Pc-Cu (Estos se determinan experimentalmente porque dependen de la densidad de la corriente, de la naturaleza del metal empleado como electrodo, del estado la superficie del electrodo, de la temperatura y de la composición del medio), luego el cálculo de los potenciales reales para cada electrodo quedaría como:
Ea = E0 + Pa-Cu
Ec = E0 - Pc-Cu
En ocaciones la magnitud del potencial de descomposición Ed encontrada por la fórmula (1) resulta menor que la encontrada experimentalmente por otras razones que no son precisamente los fenómenos de polarización por difusión. La causa de ello radica en que al calcular Ed no se ha tenido en cuenta otro tipo de polarización conocida como polarización por activación.
Si durante la electrólisis ocurre un desprendimiento gaseoso como es el caso de la oxidación, y/o reducción del agua: 2H /H2, O2 + 4H / 2H2O, o cualquier otro gas como Cl2/2Cl ,etc., se producen condiciones diferentes a las que se crean al determinar sus potenciales normales. En efecto, al determinar los potenciales normales, como electrodo se emplea siempre una placa platinada de platino (es decir recubierta de una capa de negro de platino). Durante la electrolisis el desprendimiento de gas se produce sobre la superficie de una placa (o almbre) de platino lisa (brillante).
Cambio de condiciones de transformación
Experimentalmente se ha demostrado que este cambio de condiciones de transformación de H en hidrógeno elemental o del agua, en oxígeno elemental y H , conduce a la variación de los potenciales de los pares correspondientes. Por ejemplo, mientras que el potencial normal del par 2H /H2 en el platino platinado es igual (por escala de hidrógeno) a cero, a la misma concentración de iones H y a presión del hidrógeno gaseoso sobre el electrodo de platino liso, es igual a -0.07 V. Del mismo modo, el potencial de este par cambia también al emplear electrodos de otros metales, por ejemplo, de cobre, de plomo, mercurio, etc.
Semejante cambio de potencial del par dado, al sustituir el electrodo platinado por algún otro electrodo, se denomina sobre-tensión del elemento correspondiente (hidrógeno, oxígeno, cloro, etc) en el electrodo dado.
La sobre-tensión depende de distintas magnitudes
La sobre-tensión depende de distintas magnitudes: de al densidad de la corriente, de la naturaleza del metal empleado como electrodo, del estado la superficie del electrodo y de la temperatura. Por ejemplo la sobre-tensión del Hidrógeno en el cobre constituye - 0.85 V a una densidad de corriente de 0.1 A/cm , mientras que a 0.01A/cm es igual a -0.58 V.
Si se toma en consideración la existencia de sobre-tensión, calculando el potencial de descomposición, se debe tener en cuenta no solo las magnitudes de los potenciales de oxidación reducción de los pares que se forman en en el ánodo (Ea) y en el cátodo (Ec), sino también las sobre-tensiones correspondientes en los electrodos indicados ( a y c). La formula para calcular el potencial de descomposición toma el aspecto siguiente:
Ed = (Ec - c) - (Ea + a) (2)
Reglas para escoger las reacciones anódicas y catódicas
Las reglas que se aplican para escoger las reacciones anódicas y catódicas luego de haber tenido en cuenta los efectos de polarización electroquímica y sobrevoltaje en los ajustes de potencial serán:
- En el ánodo se escoge la oxidación más probable, o sea, la de potencial mas elevado.
- En el cátodo se escoge la reducción mas probable, o sea la, de potencial de oxidación mas bajo.
Fuentes
- http://www.fq.uh.cu/dpto/qf/uclv/infoLab/practics/practicas/Electrolisis/teoria.htm
- http://redox.rimed.cu/module/biblioteca/datos_esp.php?pag=glo&num=172&Tip=ssb&idMod=7
- http://www.fq.uh.cu/dpto/qf/uclv/infoLab/practics/practicas/Electrolisis/celdas/electroq1.pdf
- http://www.bvscuba.sld.cu/php/decsws.php?tree_id=SP4.011.097.057&lang=es&PHPSESSID=bdf74369ae9f5ffa64030a68e52942ce
- http://www.fq.uh.cu/dpto/qi/pag/tabla%20periodica/los%20elementos%20quimicos.htm