Elementos químicos no metálicos
| ||||||
Elementos químicos no metálicos: Elementos químicos no metálicos: Se encuentran ubicados en la parte superior derecha de la tabla periódica. A pesar de ser estos elementos menos numerosos que los elementos metálicos, forman parte de la composición de gran cantidad de sustancias que por sus propiedades y aplicaciones tienen mucha importancia en la vida diaria, en la industria y en la Agricultura.
Sumario
Características generales
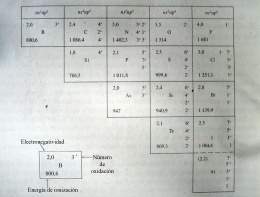
Los elementos químicos no metálicos, por regla general, tienen cuatro o más electrones ubicados en los orbitales s y p del último nivel de energía. La Energía de ionización es la energía necesaria para separar el electrón menos fuertemente retenido de un Átomo gaseoso y aislado. La Electronegatividad es el poder de atracción que ejerce un átomo sobre los Electrones del enlace. Estos elementos se caracterizan por tener relativamente altos los valores de energía de ionización y de la electronegatividad.
En sus compuestos estos elementos , excepto el flúor, pueden presentar números de oxidación positivos y negativos, en dependencia de si el átomo del elemento al que se unen es más o menos electronegativo.
El Flúor, por ser el elemento más electronegativo, presenta en todos sus compuestos números de oxidación 1-.
Las sustancias simples no metálicas tienen tendencia a ganar electrones en sus reacciones, se reducen y disminuyen sus números de oxidación , por lo que son buenos agentes oxidantes. En un grupo de la tabla periódica, al aumentar el tamaño de los átomos disminuye el carácter oxidante de las respectivas sustancias simples.
El carácter no metálico de los elementos ubicados en un mismo grupo de la tabla periódica, disminuye con el incremento del número atómico de estos. El carácter no metálico de los elementos ubicados en un mismo período de la tabla períodica, aumenta con el incremento del número atómico de estos.
Los elementos con mayores características no metálicas se encuentran al final de los períodos y al inicio de los grupos de la tabla periódica.
Propiedades físicas y estructura
A temperatura ambiente las sustancias simples no metálicas pueden ser sólidas o gaseosas, en dependencia al tipo de partículas que las forman (átomos o Moléculas) y de la fortaleza de las interacciones entre estas.
Las sustancias atómicas, como el Carbono y el Silicio, tienen temperaturas de fusión elevadas. Esto se debe que el paso del estados sólido al líquido implica una ruptura de los fuertes enlaces covalentes que unen a los átomos, lo que requiere mucha energía.
Los no metales que no son sustancias moleculares pueden estar en cualquier estado de agregación, por ejemplo, a temperatura ambiente el Dioxígeno es gaseoso, el Dibromo es Líquido mientras que el Diyodo es sólido.
Estas sustancias están formadas por moléculas apolares. No obstante, debido al constante movimiento de los eslectrones, la distribución de las cargas en estas moléculas cambian constantemente, por lo que aparecen zonas débilmente negativas y positivas, es decir, polos instantáneos. Estos polos instantáneos hacen que las moléculas Apolares se comporten como Dipolos fluctuantes, no permanentes, que provocan en otras moléculas cercanas el surgimiento de polos positivos y negativos. Todo lo anterior da lugar al surgimiento de interacciones Electrostáticas entre las moléculas, que se conocen como interacciones dipolo fluctuante-dipolo. Estas interacciones son débiles, y por esto las sustancias simples no metálicas tienen temperaturas de fusión más bajas que los átomos.
El aumento de las moléculas, por lo general, provoca un incremento de las interacciones entre estas, y con ello un aumento gradual de la temperatura de fusión de las sustancias.
Las sustancias simples no metálicas son pocos solubles en agua porque esta es una sustancia polar y las interacciones que se establecen son de tipo dipolo-dipolo fluctuante, muy débiles, que no posibilitan la disolución. Las que están formadas por moléculas son malas conductoras de la Electricidad.
Propiedades químicas de los no metales
La mayoría de los no metales reaccionan con muchos metales y se forman las sales binarias correspondientes. Las condiciones en las que ocurren estas reacciones son muy variadas. Por ejemplo, el Hierro en polvo, calentado previamente, arde al ser añadido a un frasco que contiene dicloro y se observa la formación de un sólido de color carmelita rojizo. La ecuación que describe este proceso es:
El dinitrógeno solo reacciona con los metales a elevadas temperaturas. Las sales que se forman son nitruros. Por ejemplo:
Todas las reacciones de los no metales con los metales son de redox y en ellas los no metales se reducen, por tanto actúan como agentes oxidantes. Con el Dihidrógeno se combinan directamente el carbono, el Dinitrógeno, el Dioxígeno, el Octazufre y las sustancias simples de los elementos del grupo VII – A. Estas reacciones se producen también en diferentes condiciones. Por ejemplo, la reacción entre el Diflúor y el dihidrógeno ocurre violentamente a temperatura ambiente, mientras que el Diyodo solo reacciona frente al dihidrógeo si se le suministra energía.
En general, en estas reacciones se forman los compuestos binarios hidrogenados; en ellas también, los no metales se reducen y son agentes oxidantes. Los no metales, excepto las sustancias simples del elemento del grupo VII – A, reaccionan con el dióxigeno y se producen los óxidos no metálicos correspondientes. Ejemplos:
En estas reacciones Redox, dióxigenos es el agente oxidante y los restantes son agentes reductores.