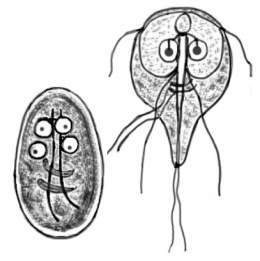
Giardia lamblia
| ||||||||
Giardia lamblia. Es un protozoo de distribución global, con mayor incidencia en zonas tropicales y subtropicales. Reconocido inicialmente como comensal inocuo del tracto digestivo, es actualmente el patógeno entérico más común en humanos. Presenta un ciclo de vida directo y su espectro clínico es en extremo variable.
A pesar de existir múltiples medicamentos de probada eficacia contra este parásito el manejo de los pacientes se hace difícil por lo frecuente de las fallas terapéuticas y los efectos colaterales.
Sumario
Historia
En 1681 Antón van Leeuwenhoek describió parásitos similares a la Giardia en sus heces. En los siguientes 250 años fue considerada como un inofensivo comensal del intestino. El primer inofensivo comensal del intestino. El primer reporte confirmado se le atribuyó a Lambl en 1859, quien la denominó Cercomonas Intestinalis.
Posteriormente en 1915 Stiles la renombró Giardia Lamblia en honor al Prof. A. Giardde París y el Dr. F. Lamblde Praga.
Evolución
Inicialmente se reconocía G. lamblia como un comensal inocuo del tubo digestivo de los humanos; sin embargo, la ocurrencia de episodios diarreicos en los cuales el parásito se ha encontrado como agente causal, así como haber llevado a cabo infecciones experimentales en humanos en las que se han cumplido los postulados de Koch, han confirmado la asociación del parásito con el desarrollo de enfermedad en los humanos y algunos animales.
El manejo y seguimiento de los individuos infectados, esencialmente niños, constituye uno de los aspectos más discutidos de esta parasitosis debido, principalmente, a las diferencias de criterios que se esgrimen con relación a sí deben tratarse o no las infecciones asintomáticas.
El lugar donde se desarrolla la infección es un elemento importante a considerar en ese sentido. Algunos autores sugieren que en sitios donde G. lamblia es endémica los niños no deben tratarse debido a que las tasas de reinfección son altas. Otros consideran que en los casos en que la parasitosis produzca alteraciones en el crecimiento y desarrollo del niño, aún cuando las tasas de reinfección sean altas, el tratamiento medicamentoso debe ser valorado.
Por otro lado algunos investigadores refieren que los niños con infecciones asintomáticas, que residen en países desarrollados y presenten un estado nutricional adecuado no deben tratarse aún cuando existe el riesgo de transmisión a los miembros de la familia y esto ayude a mantener la circulación del parásito a escala comunitaria.
Es importante conocer, además, las características biológicas del microorganismo para comprender mejor la forma de relacionarse con el individuo infectado y decidir la conducta a seguir con cada caso en particular.
Morfología y ciclo de vida
G. lamblia habita en las primeras porciones del intestino delgado, donde el pH es ligeramente alcalino y le resulta favorable para su desarrollo. Su ciclo de vida se caracteriza por la existencia del trofozoíto y el quiste.
El trofozoíto mide 12-15 µm de longitud por 5-9 µm de ancho, posee una superficie dorsal convexa y una superficie ventral plana en la que se encuentra el disco suctorial que le facilita la adhesión a la mucosa del intestino delgado. Cuenta con 2 núcleos y 4 pares de flagelos.
Los quistes constituyen la forma infectante de este protozoo. Acceden a los huéspedes susceptibles al ser ingeridos con el agua de consumo, los alimentos o directamente de persona a persona por prácticas sexuales oro-anales.
Una vez ingeridos los quistes, el proceso de exquistación se inicia en las primeras porciones del intestino delgado. Aunque no se conocen claramente los mecanismos exactos involucrados en el proceso, es probable que la influencia del cambio de pH entre el estómago y el duodeno, unido a la participación de enzimas digestivas sean elementos favorecedores.
Como resultado aparecen dos nuevos trofozoítos que viven y se multiplican asexualmente en la superficie mucosa del intestino delgado. El parásito se encuentra, habitualmente, en el duodeno y primeras porciones del yeyuno de los individuos infectados y es consenso general que no desarrolla fenómenos invasivos.
Por condiciones no bien conocidas; entre las que se señalan, los cambios bruscos de pH entre el estómago y el duodeno y, posiblemente, la acción de enzimas digestivas, pero aparentemente adversas para los trofozoítos se desarrolla la enquistación.
Los quistes son eliminados al exterior y pueden, potencialmente, infectar un nuevo huésped inmediatamente después de haber sido excretados. Esta forma de resistencia en el medio exterior tiene la capacidad de mantenerse con vida varios meses a bajas temperaturas.
Epidemiología
Giardia tiene una distribución mundial. Su frecuencia es mayor en zonas tropicales y subtropicales donde la temperatura, la humedad y las malas condiciones higiénicas favorecen su transmisión.
Es frecuente, en animales domésticos, especialmente perros, gatos y se presenta con relativa frecuencia en animales salvajes como los castores. La transmisión a partir de la exposición a quistes del parásito provenientes de fuente animal ha sido reportada, a pesar de reconocerse como una vía no común de adquisición de la infección. En países en vías de desarrollo, G. lamblia afecta entre un 20 a un 30% de la población, siendo los niños menores de 5 años los mas afectados debido a sus hábitos gregarios.
En los países desarrollados, el parásito es frecuente en guarderías. Sin embargo, se reporta también en nadadores, campistas, homosexuales, viajeros internacionales a áreas endémicas y personas que viven en condiciones de hacinamiento como: refugiados, ancianos en instituciones para la tercera edad e individuos con trastornos mentales recluidos en sanatorios. Este parásito es además la principal causa de brotes de transmisión hídrica en estos países.
Se estima que los portadores sanos de quistes representan el 15% de la población adulta y hasta el 50% de la población infantil y que estos son los mayores responsables de la diseminación de la infección en el hogar y a escala comunitaria.
La adquisición del parásito requiere la ingestión de los quistes, lo cual está relacionado con la ingestión de aguas y alimentos contaminados; aunque cada vez se reporta con más frecuencia la transmisión de persona a persona. Experimentalmente se ha desarrollado la infección con la ingestión de 10 quistes del parásito, pero diferentes autores refieren que uno sólo es suficiente para desencadenar el proceso infeccioso.
La hipoacidéz, la gastrectomía, la pancreatitis crónica, así como las dietas ricas en carbohidratos, hierro y colesterol, constituyen factores predisponentes a la infección. Los niños menores de 5 años, los homosexuales, los viajeros internacionales, los individuos en instituciones cerradas y posiblemente los inmunodeprimidos tienen una probabilidad especialmente elevada a adquirir la parasitosis.
Manifestaciones clínicas
El espectro clínico de la infección por G. lamblia varía de acuerdo a la intensidad de la infección, la cepa del parásito y el estado inmunológico del paciente. Oscila desde casos asintomáticos hasta casos con diarrea severa y persistente asociada con malabsorción.
La forma aguda se caracteriza por tener un inicio brusco, con diarreas malolientes y acuosas que tienden a flotar en el agua. Es frecuente la aparición de náuseas, vómitos y distensión abdominal, así como dolor en región epigástrica. No aparecen signos de invasión de la mucosa como sangre en las heces o fiebre.
La presencia de moco en las heces no suele reportarse, a no ser por la existencia de otras parasitosis o enfermedades que así lo justifiquen. La Giardiosis aguda suele ser autolimitada en un periodo de 2 a 7 días; sin embargo, puede prolongarse y desarrollar cuadros diarréicos subagudos o crónicos.
La forma crónica de la infección se caracteriza por periodos diarréicos con heces pastosas y espumosas acompañadas de flatulencia y meteorismo que alternan con periodos en que las deposiciones son aparentemente normales. En algunos pacientes la infección cursa con malabsorción y las consecuencias clínicas que de ella se derivan.
Es conocido que G. lamblia puede conducir a trastornos de la absorción intestinal y, por ende, producir estados deficitarios de tal magnitud que conduzcan a desnutrición. Sin embargo, es también conocido que los estados de desnutrición asociados a deterioro del sistema inmunitario de mucosas predisponen a las infecciones por parásitos intestinales. Lo anterior evidencia que los daños que se observan al parecer son multicausales y dependen de múltiples fenómenos que coinciden en el tiempo en una misma persona o población.
Patogénia
Los quistes de G. lamblia, una vez ingeridos, pasan por el estómago y se convierten en trofozoítos en el duodeno. Se diseminan por este órgano y por el yeyuno, adhiriéndose por medio de su ventosa ventral a la superficie de las células del epitelio intestinal.
Este protozoo puede desarrollar un espectro de anomalías en la arquitectura de las vellosidades intestinales que va desde una apariencia completamente normal al microscopio óptico hasta una atrofia parcial o total de las vellosidades. Se puede presentar un acortamiento ligero de las vellosidades y un incremento en la profundidad de las criptas. Las anormalidades morfológicas traen consigo una reducción de la actividad enzimática en la membrana de las micro-vellosidades.
El incremento en la profundidad de las criptas, visto en humanos y en modelos animales de experimentación, se asocia con un incremento en la producción de las células a este nivel y una rápida migración de los enterocítos en la vellosidad.
El sobrecrecimiento bacteriano frecuentemente encontrado en individuos con esta parasitosis facilita la adhesión y genera condiciones favorables para el desarrollo del microorganismo en el intestino delgado.
Diagnóstico
El diagnóstico de esta parasitosis se realiza habitualmente al encontrar quistes y/o trofozoítos en heces o estos últimos en el aspirado o biopsia duodeno-yeyunal. El examen de una sola muestra de heces es capaz de detectar sólo el 60% de los casos positivos. Esto, en gran medida, se debe a que el examen en muchas ocasiones se realiza horas después de la defecación lo que imposibilita la observación de trofozoítos debido a la destrucción de estos.
Se debe considerar además la intermitencia con que los quistes son eliminados. Estos resultados pueden ser mejorados al examinar de tres a seis muestras de heces en un período de diez días y mediante la utilización de técnicas de concentración. El estudio microscópico del líquido duodenal obtenido por sondaje, el uso de la cápsula de Beal o la biopsia duodenal son alternativas en casos de difícil diagnóstico.
Las pruebas serológicas para la detección de anticuerpos anti-G. lamblia han sido utilizadas, pero presentan desventajas debido a la variabilidad en la respuesta inmune humoral de cada paciente y a que en ocasiones se presentan reacciones cruzadas. Debido a ello, se han desarrollado técnicas para la detección de antígenos del parásito en heces por métodos inmunológicos; los más usados han sido los ensayos inmunoenzimáticos en fase sólida (ELISA), con los que se han obtenido valores de sensibilidad y especificidad superiores al 98%.
Manejo de esta parasitosis
G. lamblia, como otros muchos microorganismos que producen enfermedad en humanos, es curable. Múltiples fármacos son útiles en este sentido, sin embargo, el problema muchas veces no radica en el medicamento en sí sino en las orientaciones que se le ofrecen a cada uno de los pacientes y el adecuado seguimiento de la prescripción médica.
El período prepatente de la infección por este protozoo es de aproximadamente 12 días, de ahí que a todo paciente a quien se le oriente un tratamiento antigiardiásico se le debe orientar además tres exámenes de heces entre los 3 y 10 días luego de terminada la administración del producto, especialmente en regiones altamente endémicas.
Las muestras de heces deben ser colectadas por defecación espontánea, en frascos limpios y secos, y llevadas de inmediato al laboratorio para su procesamiento. Ya en este lugar el personal especializado debe proceder al análisis de las heces utilizando el examen directo de heces y, además, alguna técnica de concentración para protozoos como la técnica de etil-acetato también conocida como técnica de Ritchie, o la de Faust, con las cuales se disminuye significativamente la probabilidad de que algún paciente no curado parasitológicamente se reporte como tal.
Si estos exámenes resultan positivos se considera al paciente no curado parasitológicamente y entonces otro fármaco debe ser utilizado. Si por el contrario los exámenes resultan negativos se considera al individuo curado.
Pasados a lo sumo 1 día de terminado el tratamiento con cualquier fármaco antigiardiásico, el individuo no tiene concentración del medicamento en el organismo que pueda defenderlo ante una nueva exposición al parásito.
Potencialmente, puede infectarse nuevamente y pasados los días correspondientes al período prepatente de la infección los exámenes parasitológicos serán nuevamente positivos a este parásito. Esta situación no se debe a que el medicamento no curó el proceso infeccioso, sino a que el individuo se reinfectó, por lo cual el fármaco usado de inicio sí fue efectivo.
Elementos a tener en cuenta por el pasiente
- Tomar el medicamento antigiardiásico con la frecuencia y durante el tiempo indicados por el facultativo.
- De aparecer efectos adversos por el uso del fármaco, comunicarlo rápidamente a su médico para valorar el cambio de medicamento.
- Debe cumplir totalmente los consejos recibidos para evitar las reinfecciones, a su vez entregar en tiempo y con las condiciones adecuadas, las muestras de heces que se le soliciten por el laboratorio.
Tratamiento
Es difícil comparar estudios cuando se evalúa la eficacia clínica de los fármacos usados en el tratamiento de la infección por G. lamblia debido a las diferencias en la metodología seguida en las diferentes investigaciones. Hasta el momento no se cuenta con un fármaco ideal con el que se logre un alto porciento de curación con pocos o ningún efecto indeseable.
Históricamente esta parasitosis fue tratada con mercuriales, productos arsenicales y bismuto. Sin embargo, la introducción de la quinacrina (Atabrine, Mepacrine) en la década del treinta como agente antimalárico, y su uso más tarde como medicamento antigiardiásico con eficacia superior al 90%, constituyó un importante paso de avance en la terapéutica.
Independientemente de la eficacia demostrada, la frecuente aparición de efectos indeseables reportados que incluyen; nauseas, vómitos, cloración amarilla-naranja de la piel, esclera y orina, cefalea y malestar general ha traído aparejado una disminución drástica de su empleo, así como el cese de su producción en algunos países, incluido los Estados Unidos de Norteamérica.
Quinacrina no debe utilizarse en pacientes con psoriasis o con trastornos Psicopáticos, ni tampoco en aquellos con déficit de glucosa 6-fosfato deshidrogenasa pues puede precipitar los episodios de hemólisis. Este medicamento tampoco debe ser usado en el embarazo pues se ha asociado con la aparición de agenesia renal. Usualmente este fármaco se debe administrar a razón de 100 mg cada 8 horas en adultos y 6 mg por kilogramo de peso corporal distribuidos cada 8 horas en niños. En ambos casos por un período de 7 a 10 días.
La furazolidona (Furoxone, Fuxol, Furodone), es un producto efectivo contra gran cantidad de bacterias y su utilización en el tratamiento de esta parasitosis se inició en los años cincuentas. Estudios realizados en la década de los ochentas indican que las tasas de curación alcanzadas con este compuesto oscilan entre 80 y 90% y sugieren su uso en población infantil, entre otras razones, por sus mínimos efectos indeseables y por presentarse en suspensión. La dosis recomendada en adultos es de 100 mg cada 6 horas y, en niños, 8 mg por kilogramo de peso corporal distribuidos cada 6 horas. Este régimen debe ser mantenido por 7 a 10 días.
Los 5-nitroimidazoles constituyen las drogas más usadas para el tratamiento de la infección por este parásito dada las elevadas tasas de curación reportadas, el bajo costo y la facilidad con que se pueden adquirir. La introducción de este grupo de medicamentos se produjo en el año 1955 y ya para el año 1962, Darbon et al. Reportaron su efectividad como drogas antigiardiásicas.
Dentro de ellos, el metronidazol ha sido el más estudiado y sus tasas de curación oscilan entre 60 y 100%. La dosis recomendada en este caso es de 250 mg cada 8 horas en adultos y 15 mg por kilogramo de peso corporal distribuidos cada 8 horas en niños, en ambos casos el tratamiento debe llevarse por 5 días.
Es importante señalar que algunos reportes evidencian la existencia de fallas terapéuticas con su uso. Los efectos adversos que comúnmente se reportan con el empleo de metronidazol son; cefalea, sabor metálico, oscurecimiento de orina, vértigo y nauseas. En menor frecuencia se reporta además; pancreatitis, toxicidad del Sistema Nervioso Central, neutropenia reversible y neuropatía periférica. No se recomienda el uso del medicamento en el primer trimestre del embarazo.
Secnidazol y tinidazol son otros 5-nitroimidazoles ampliamente utilizados. La posibilidad de emplearlos en mono-dosis y la menor probabilidad de aparición de efectos indeseables luego de su uso han determinado que progresivamente se generalice su utilización a la hora de tratar a pacientes infectados por G. lamblia.
Los bencimidazoles se han usado con relativa frecuencia. De ellos, el albendazol, es el que mejores resultados ha brindado tanto en estudios in vitro, como clínicos.
Un estudio recientemente publicado en el que se evaluó la eficacia de cloroquina, albendazol y tinidazol en el tratamiento de 165 niños con Giardiosis evidenció que el porciento de curación obtenido con cloroquina fue de 86% sin diferencia estadísticamente significativa con lo alcanzado con tinidazol 91%. Ambas drogas superaron en eficacia a albendazol. La dosis de albendazol evaluada fue de 400 mg diarios por un período de 5 días.
Mebendazol ha sido menos utilizado, pero algunos estudios sugieren su elevada eficacia contra G. lamblia. En ese sentido un estudio reciente, realizado en Cuba en niños entre 5 a 15 años, en el cual se utilizó mebendazol por tres días y se comparó los resultados con otro grupo de niños tratados con secnidazol en dosis única, no mostró diferencias significativas entre los fármacos en cuestión.
El 78.08% de los niños curaron con mebendazol en tanto que el 79.45% de ellos curaron con secnidazol. Este estudio sugiere el uso de mebendazol en casos en los que las drogas de primera línea no puedan ser utilizadas por intolerancia o en individuos con infecciones helmínticas asociadas.
Nitazoxanida es un derivado 5-nitrotiazol, relativamente nuevo, que salió al mercado Mexicano para uso en humanos en 1996 autorizado por la Dirección General de Insumos para la Salud. Algunos estudios en los que se ha evaluado este fármaco contra Giardia sugieren su utilidad para este fin. Los porcientos de curación oscilan entre un 70 y 80%.
Diversos medicamentos han sido ensayados, algunos in vitro, otros in vivo y muchos en ambas condiciones. Entre ellos azitromicina, paromomicina, doxiciclina. Además, se investigan nuevas alternativas de tratamiento que incluyen las plantas de uso etnobotánico con las que hasta la fecha se han obtenido buenos resultados.
Resumen
Finalmente se debe recordar que una adecuada intervención higiénico-sanitaria seria suficiente para evitar nuevas infecciones por este protozoo, sin embargo, el tratamiento y seguimiento adecuado redundarían en la curación de los individuos ya infectados y en la prevención de la diseminación del proceso infeccioso.
Enlaces externos
- Artículo Giardia lamblia. Disponible en "www.revista-api.com". Consultado: 6 de septiembre del 2011.
Fuentes
- Artículo Historia de la Giardia lamblia. Disponible en "es.scribd.com". Consultado: 6 de septiembre del 2011.
- Artículo Giardia lamblia. Disponible en "es.wikipedia.org". Consultado: 6 de septiembre del 2011.