Diferencia entre revisiones de «Hidróxidos no metálicos»
(→Fórmula) |
|||
| Línea 11: | Línea 11: | ||
==Fórmula== | ==Fórmula== | ||
| − | '''Óxido ácido + | + | '''Óxido ácido + H<sub>2</sub>O ---------> (HXO)Hidróxido no metálico'''<br> |
H--representa al Hidrógeno<br> | H--representa al Hidrógeno<br> | ||
X--representa al no metal<br> | X--representa al no metal<br> | ||
O--representa al oxígeno<br> | O--representa al oxígeno<br> | ||
===Ver Ejemplos=== | ===Ver Ejemplos=== | ||
| − | * | + | *SO<sub>3</sub> (s) + H<sub>2</sub>O(l) = H<sub>2</sub>SO<sub>4</sub> (ac) |
| − | * | + | *N<sub>2</sub>O<sub>5</sub> (g) + H<sub>2</sub>O(l) = 2HNO<sub>3</sub> (ac) |
| − | * | + | *P<sub>4</sub>O<sub>10</sub> (s) + H<sub>2</sub>O(l) = 4 H<sub>3</sub>PO<sub>4</sub> (ac) |
| − | == | + | == Descripción == |
Los hidróxidos no metálicos son sustancias ternarias constituidas por [[Oxígeno|oxígeno]], [[Hidrógeno|hidrógeno]] y otro elemento no metálico. <br> | Los hidróxidos no metálicos son sustancias ternarias constituidas por [[Oxígeno|oxígeno]], [[Hidrógeno|hidrógeno]] y otro elemento no metálico. <br> | ||
Las disoluciones de los hidróxidos no metálicos tienen propiedades contrarias a las de los [[Hidróxidos metálicos|hidróxidos metálicos]]. Estas propiedades se conocen con el nombre de propiedades ácidas por lo que se leen con la palabra ácido y el nombre del no-metal.<br> | Las disoluciones de los hidróxidos no metálicos tienen propiedades contrarias a las de los [[Hidróxidos metálicos|hidróxidos metálicos]]. Estas propiedades se conocen con el nombre de propiedades ácidas por lo que se leen con la palabra ácido y el nombre del no-metal.<br> | ||
Por ejemplo: <br> | Por ejemplo: <br> | ||
| − | *Ácido sulfúrico, | + | *Ácido sulfúrico, H<sub>2</sub>SO<sub>4</sub>. (El conocido ácido de acumulador es una disolución de esta sustancia). |
| − | *Ácido nítrico, | + | *Ácido nítrico, HNO<sub>3</sub>. |
| − | *Ácido fosfórico, | + | *Ácido fosfórico, H<sub>2</sub>PO<sub>4</sub>. |
| − | *Ácido bórico, | + | *Ácido bórico, H<sub>2</sub>BO<sub>3</sub>. |
== Propiedades == | == Propiedades == | ||
| Línea 34: | Línea 34: | ||
*Son compuestos moleculares, es decir, son compuestos que no tienen iones, sin embargo tienen la propiedad de formar iones [[Hidrógeno|hidrógenos]] positivos e iones halogénicos negativos, en el momento de disolverse en agua. | *Son compuestos moleculares, es decir, son compuestos que no tienen iones, sin embargo tienen la propiedad de formar iones [[Hidrógeno|hidrógenos]] positivos e iones halogénicos negativos, en el momento de disolverse en agua. | ||
*No conducen la [[Corriente eléctrica|corriente eléctrica]], sin embargo, sus disoluciones acuosas si la conducen. | *No conducen la [[Corriente eléctrica|corriente eléctrica]], sin embargo, sus disoluciones acuosas si la conducen. | ||
| − | *Cuando se disuelven en agua, originan iones poliatómicos oxigenados negativos e iones hidronio, H+ (ac) | + | *Cuando se disuelven en agua, originan iones poliatómicos oxigenados negativos e iones hidronio, H<sup>+</sup> (ac) |
*Tienen sabor ácido | *Tienen sabor ácido | ||
| Línea 41: | Línea 41: | ||
===Nomenclatura química=== | ===Nomenclatura química=== | ||
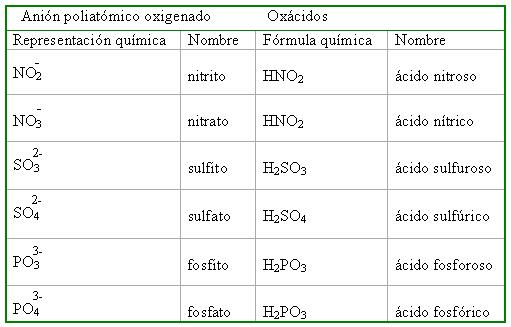
| − | Para nombrar estos compuestos se usa la palabra genérica | + | Para nombrar estos compuestos se usa la palabra genérica ácido y a continuación el nombre del anión poliatómica oxigenado cambiando su terminación ito por oso y ato por ico. <br> |
[[Image:Nomenc Hidr no metal..JPG]] | [[Image:Nomenc Hidr no metal..JPG]] | ||
| Línea 60: | Línea 60: | ||
== Véase también. == | == Véase también. == | ||
| − | *[[ | + | *[[Óxidos|Los óxidos]] |
*[[Sales|Sales]] | *[[Sales|Sales]] | ||
== Fuentes== | == Fuentes== | ||
| − | * | + | *Libro de texto de [[Química]]. Parte 2. Secundaria Básica. |
[[Category:Química]] | [[Category:Química]] | ||
Revisión del 08:15 31 may 2011
| ||||||
Hidróxidos no metálicos. Sustancias que se obtienen por la reacción del agua y un óxido no metálico. También son denominados ácidos oxigenados u oxoácidos.
Se obtienen por la combinación de un anhídrido (también llamado óxido ácido) con el agua.
Sumario
Fórmula
Óxido ácido + H2O ---------> (HXO)Hidróxido no metálico
H--representa al Hidrógeno
X--representa al no metal
O--representa al oxígeno
Ver Ejemplos
- SO3 (s) + H2O(l) = H2SO4 (ac)
- N2O5 (g) + H2O(l) = 2HNO3 (ac)
- P4O10 (s) + H2O(l) = 4 H3PO4 (ac)
Descripción
Los hidróxidos no metálicos son sustancias ternarias constituidas por oxígeno, hidrógeno y otro elemento no metálico.
Las disoluciones de los hidróxidos no metálicos tienen propiedades contrarias a las de los hidróxidos metálicos. Estas propiedades se conocen con el nombre de propiedades ácidas por lo que se leen con la palabra ácido y el nombre del no-metal.
Por ejemplo:
- Ácido sulfúrico, H2SO4. (El conocido ácido de acumulador es una disolución de esta sustancia).
- Ácido nítrico, HNO3.
- Ácido fosfórico, H2PO4.
- Ácido bórico, H2BO3.
Propiedades
- Los hidróxidos no metálicos son, a temperatura ambiente, sustancias líquidas o sólidas de relativamente bajas temperaturas de fusión y de ebullición y en general sustancias solubles en agua.
- Son compuestos moleculares, es decir, son compuestos que no tienen iones, sin embargo tienen la propiedad de formar iones hidrógenos positivos e iones halogénicos negativos, en el momento de disolverse en agua.
- No conducen la corriente eléctrica, sin embargo, sus disoluciones acuosas si la conducen.
- Cuando se disuelven en agua, originan iones poliatómicos oxigenados negativos e iones hidronio, H+ (ac)
- Tienen sabor ácido
Nomenclatura y notación química
Nomenclatura química
Para nombrar estos compuestos se usa la palabra genérica ácido y a continuación el nombre del anión poliatómica oxigenado cambiando su terminación ito por oso y ato por ico.
Notación química
Para escribir la fórmula química de un hidróxido no metálico se procede de la siguiente forma.
Archivo:Notac Hidr no metal..JPG
Aplicaciones
Los ácidos tienen gran aplicación en la industria.
- Se utilizan en la obtención de diversas sales, colorantes, medicamentos y otros productos de gran demanda.
- Los ácidos sulfúricos y clorhídricos son usados en soldaduras para eliminar las capas de óxidos que tienen algunos metales antes de recubrirlos con otros metales.
- Se utilizan además en la limpieza de objetos de metal, al tener la propiedad de reaccionar con los óxidos metálicos
- En la industria azucarera, se utilizan los ácidos, para limpiar las incrustaciones de carbonatos en las paredes de las calderas de vapor y en las tuberías.
- Otros ácidos se utilizan en la medicina, el ácido acetilsalicilico (La aspirina) como analgésico y anticoagulante.
Véase también.
Fuentes
- Libro de texto de Química. Parte 2. Secundaria Básica.