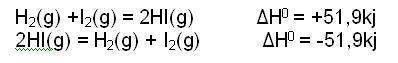Diferencia entre revisiones de «Ley de Hess»
(Página creada con '{{Desarrollo}}{{Definición |nombre= Ley de Hess |imagen= |tamaño= |concepto= }} '''Ley de Hess''': Reconocida por el científico ruso Herman H. Hess en 1840. La cual ...') |
(→Fuente) |
||
| (No se muestran 4 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | + | {{Definición | |
|nombre= Ley de Hess | |nombre= Ley de Hess | ||
| − | |imagen= | + | |imagen=LHimg1.jpg |
|tamaño= | |tamaño= | ||
| − | |concepto= | + | |concepto= Diagrama que representa la energía involucrada durante la formación del dióxido de carbono(directamente o por etapas) |
| − | }} '''Ley de Hess''' | + | }} '''Ley de Hess.''' Reconocida por el científico ruso [[Germain Henri Hess]] en [[1840]]. La cual plantea que la energía calorífica absorbida o desprendida en una reacción [[Química]] solo depende del estado inicial (sustancias reaccionantes) y del estado final (sustancias productos). |
| − | ==Experimentos== | + | == Experimentos == |
| − | |||
| − | + | Experimentalmente se ha demostrado que la energía calorífica desprendida en la formación de una muestra de 1 mol de dióxido de carbono a partir de sus sustancias simples, es la misma si la reacción produce directamente dióxido de carbono o si primero se obtiene monóxido de carbono y luego este se oxida a [[Dióxido de carbono|dióxido de carbono]]. | |
| − | + | Hay reacciones químicas que se pueden producir en un sentido o en el contrario, un ejemplo es la formación de [[Yoduro de hidrógeno|yoduro de hidrógeno]] a partir de las sustancias simples y su descomposición en las sustancias simples. | |
| − | + | [[Image:LHimg2.jpg]]<br> | |
| − | |||
| + | == Expresión matemática == | ||
| + | El valor absoluto de la variación de entalpía es el mismo solo cambia su signo; la formación de HI es un proceso [[Endotérmico|endotérmico]] y su composición es [[Exotérmica|exotérmica]]. La variación de [[Entalpía|entalpía]] es una función adecuada para expresar abreviadamente la Ley de Hess, por lo que la expresión matemática de dicha Ley es : | ||
| − | + | <br> | |
| − | + | [[Image:LHimg3.jpg]]<br> | |
| − | |||
| + | La ecuación anterior facilita el cálculo de los valores de energía involucrados en las reacciones químicas sin tener que recurrir constantemente a ensayos experimentales, con lo que en laboratorios e industrias se pueden ahorrar tiempo y recursos. | ||
| + | == Ejercicio == | ||
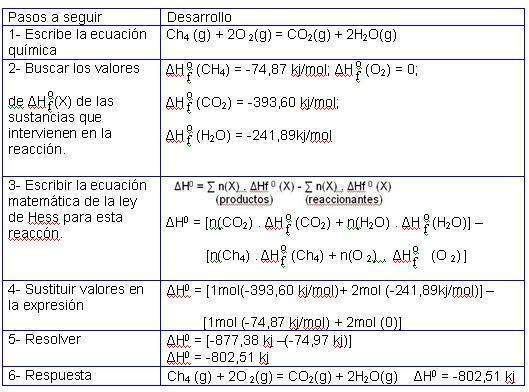
| + | Calcule la variación de entalpía de la reacción de combustión del [[Metano|metano]] representada por la ecuación: [[Image:LHimg4.jpg|center]] | ||
| + | Respuesta.<br> | ||
| − | + | [[Image:LHimg5.jpg|center|600x500px]] | |
| − | ==Fuente== | + | == Fuente == |
| − | |||
| − | [[Category: | + | *Hernández Piedra Zoila M. Peña Calviño Silvia. Curso de superación integral para jóvenes. [[Química]] II. Editorial Pueblo y Educación. [[Abril]] [[2008]]. |
| + | |||
| + | [[Category:Termodinámica]] | ||
última versión al 12:53 6 ago 2012
| ||||||
Ley de Hess. Reconocida por el científico ruso Germain Henri Hess en 1840. La cual plantea que la energía calorífica absorbida o desprendida en una reacción Química solo depende del estado inicial (sustancias reaccionantes) y del estado final (sustancias productos).
Experimentos
Experimentalmente se ha demostrado que la energía calorífica desprendida en la formación de una muestra de 1 mol de dióxido de carbono a partir de sus sustancias simples, es la misma si la reacción produce directamente dióxido de carbono o si primero se obtiene monóxido de carbono y luego este se oxida a dióxido de carbono.
Hay reacciones químicas que se pueden producir en un sentido o en el contrario, un ejemplo es la formación de yoduro de hidrógeno a partir de las sustancias simples y su descomposición en las sustancias simples.
Expresión matemática
El valor absoluto de la variación de entalpía es el mismo solo cambia su signo; la formación de HI es un proceso endotérmico y su composición es exotérmica. La variación de entalpía es una función adecuada para expresar abreviadamente la Ley de Hess, por lo que la expresión matemática de dicha Ley es :
La ecuación anterior facilita el cálculo de los valores de energía involucrados en las reacciones químicas sin tener que recurrir constantemente a ensayos experimentales, con lo que en laboratorios e industrias se pueden ahorrar tiempo y recursos.
Ejercicio
Calcule la variación de entalpía de la reacción de combustión del metano representada por la ecuación:
Respuesta.