Leyes de la electrólisis de Faraday
| ||||||
Leyes de la electrólisis de Farady: expresan relaciones cuantitativas en base a las investigaciones electroquímicas publicadas por Michael Faraday en 1834.
Sumario
Introducción
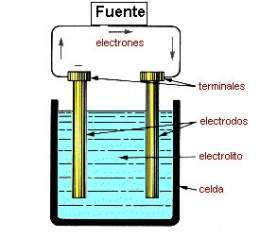
Los líquidos son conductores de la corriente eléctrica (electrólitos, conductores de segunda clase) si, bajo la acción de un campo eléctrico externo, puede efectuarse en ellas el movimiento ordenado de los iones.
El movimiento ordenado de los iones en los líquidos conductores se produce en el campo eléctrico creado por los electrodos, o sea conductores unidos a los polos de una fuente de energía eléctrica. El electrodo positivo recibe el nombre de ánodo y el negativo, el cátodo. Los iones positivos (cationes) se mueven hacia el cátodo y los iones negativos (aniones) se mueven hacia el ánodo. La corriente eléctrica en los electrólitos va acompañada de el fenómeno de la electrolisis, desprendimiento en los electrodos de las partes componentes de las sustancias disueltas o de otras, resultantes de reacciones secundarias en los electrodos.
Primera ley de Faraday (primera ley de la electrólisis)
La masa M de sustancia que se desprende en el electrodo es directamente proporcional a la carga eléctrica Q que pasa por el electrólito si a través de éste se hace pasar durante el tiempo t una corriente continua de intensidad I.
El coeficiente de proporcionalidad k se denomina equivalente electroquímico de la sustancia. Este coeficiente es numéricamente igual a la masa de sustancia desprendida cuando por el electrólito pasa la unidad de carga eléctrica y depende de la naturaleza química de la sustancia.
Segunda ley de Faraday (segunda ley de la electrólisis)
Los equivalentes electroquímicos de los elementos son directamente proporcionales a sus equivalentes químicos
Donde C es cierta constante universal para todos los elementos y kx es el equivalente químico
Aquí A es la masa atómica del elemento (en kg/mol), y z, su valencia. Así pues
Siendo
La constante de Faraday, conocida también como número de Faraday.
Ley unificada de Faraday (ley unificada de la electrólisis)
m = M(X/z*)It / F → (96500 C = 1 Faraday (F))
Permite esclarecer el sentido físico de F, porque precisamente cuando M = A / z, el número de Faraday F = Q. La cantidad de sustancia igual a 1 / z moles recibe el nombre de equivalente-gramo. Cuando z = 1, el equivalente gramo de la sustancia es igual a un mol. La constante de Faraday es numéricamente igual a la carga eléctrica que hay que hacer pasar por el electrólito para que se desprenda en el electrodo un equivalente–gramo de sustancia.
Fuentes
- Yavorski,B.M y Detlaf, A.A. Prontuario de Física. Editorial Mir. 1983. Pág 274.
- Información ofrecida por MSc. José Ramón Ávila Cruz (JC Puerto Padre V)
- http://karin.fq.uh.cu/~cnv1/qf/uclv/infoLab/infoquim/asig_programs/lecciones/09electroqu%EDmica/lecci%F3n13.doc