Matriz extracelular
| ||||||
Matriz extracelular (MEC). Es el conjunto de materiales extracelulares que forman parte de un tejido. La MEC es un medio de integración fisiológico, de naturaleza bioquímica compleja, en el que están "inmersas" las células. Así la MEC es la sustancia del medio intersticial (intercelular).
Es un entramado de moléculas, proteínas y carbohidratos que se disponen en el espacio intercelular y que es sintetizado y secretado por las propias células.
Sumario
Funciones
- Aporta propiedades mecánicas a los tejidos (tanto en animales como en vegetales).
- Mantiene la forma celular.
- Permite la adhesión de las células para formar tejidos.
- Sirve para la comunicación intercelular.
- Forma sendas por las que se mueven las células.
- Modula la diferenciación celular y la fisiología celular.
- Secuestra factores de crecimiento.
Generalidades
La cantidad, la composición y la disposición de la matriz extracelular depende del tipo de tejido considerado. Hay algunos como el epitelial y el nervioso que carecen o tienen muy poca matriz extracelular, mientras que en otros como el tejido conectivo es el elemento más importante en volumen.
En los tejidos vegetales la pared celular se puede considerar, aunque no siempre hay acuerdo, como una matriz extracelular especializada con unas características muy diferentes a la de los tejidos animales. Su papel es crucial para dar rigidez a las células y por extensión a la planta, es una barrera a la permeabilidad, protege frente a las agresiones de patógenos o mecánicas, entre otras funciones.
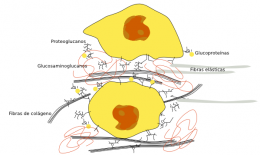
Principales macromoléculas que componen la matriz extracelular
- Colágeno.
- Elastina.
- Glucosaminoglucanos.
- Proteoglucanos.
- Glucoproteínas.
Todas ellas se encuentran en un medio acuoso junto con otras moléculas de menor tamaño, además de los iones. Es la cantidad, la proporción y el tipo de cada una de estas macromoléculas lo que distingue a unas matrices extracelulares de otras.
Colágeno
Se denomina colágeno a una familia de proteínas muy abundante en el organismo de los animales. Las moléculas de colágeno pueden representar del 25 al 30 % de todas las proteínas corporales.
Su principal misión en los tejidos es formar un armazón que hace de sostén a los tejidos y que resiste las fuerzas de tensión mecánica. La organización de las moléculas de colágeno en estructuras macromoleculares tridimensionales es variada. Pueden formar fibras paralelas para resistir tensiones unidireccionales, como ocurre en tendones y ligamentos, o fibras orientadas en forma de malla para soportar tensiones que pueden venir de todas las direcciones, como ocurre en el hueso, en el cartílago y en el tejido conectivo.
Las células se "agarran" a las moléculas de colágeno mediante diversas proteínas de adhesión como las integrinas, inmunoglobulinas, anexinas, etcétera. Las moléculas de colágeno se caracterizan por: a) Una composición poco frecuente de aminoácidos. En las moléculas de colágeno abunda el aminoácido glicina, que es muy común, y otros menos comunes como la prolina e hidroxiprolina. b) Pueden organizarse formando fibras, mallas o especializarse en formar uniones entre moléculas. Todo ello depende de la composición química de sus subunidades α y de los tipos de subunidades que lo formen.
Elastina
Las moléculas de elastina están unidas entre sí mediante enlaces entre las regiones ricas en el aminoácido lisina. Es una proteína abundante en muchas matrices extracelulares y aparece como un componente de las denominadas fibras elásticas, las cuales son agregados insolubles de proteínas.
Las fibras elásticas tienen la capacidad de estirarse en respuesta a las tensiones mecánicas y de contraerse para recuperar su longitud inicial en reposo. La elasticidad de los tejidos depende de las fibras elásticas. Se encuentran sobre todo en la dermis, en las paredes de las arterias, en el cartílago elástico y en el tejido conectivo de los pulmones. Además de la elastina, que representa el 90 %, las fibras elásticas están formadas por las denominadas microfibrillas de fibrilina y por otras glucoproteínas y proteoglucanos en menor proporción.
Otras funciones de las fibras elásticas son aportar sostén a los tejidos o regular la actividad de los factores de crecimiento TGF-β mediado por la fibrilina.
La elastina posee una larga cadena de aminoácidos en la que hay numerosas secuencias con aminoácidos hidrófobos, separadas por otras secuencias que contienen parejas de glicinas y otros aminoácidos pequeños como la lisina. Esta composición de aminoácidos es la que confiere las propiedades elásticas, puesto que los aminoácidos hidrófobos permiten la disposición en estructuras arrolladas y la lisina la formación de α-hélices, que son los puntos donde se enlanzan dos moléculas de elastina próximas. La elastina parece ser una invención de los vertebrados, puesto que no se ha encontrado en invertebrados.
Glucosaminoglucanos
Son polímeros no ramificados de azúcares que pueden formar cadenas muy largas. Están formados por repeticiones de parejas de monosacáridos donde uno de los azúcares tiene un grupo amino (N-acetilgalactosamina o N-acetilglucosamina) y el otro es normalmente la galactosa o el ácido glucurónico. Estos azúcares poseen grupos carboxilo (COO-) y grupos sulfatos (SO3-), cuyas cargas negativas permiten una fuerte y abundante asociación con moléculas de agua, aportando una gran hidratación a la matriz extracelular. Los glucosaminoclucanos son moléculas poco flexibles por lo que ocupan un gran volumen y gracias a su fuerte hidratación hacen que la matriz extracelular se comporte como un gel. Esto permite que los tejidos que poseen una alta proporción de glucosaminoglucanos puedan resistir fuertes presiones mecánicas y además favorece una alta tasa de difusión de sustancias entre las célula. Los tipos más comunes de glulcosaminoglucanos son el ácido hialurónico y los glucosaminoglucanos sulfatados: condroitín sulfato, dermatán sulfato, queratán sulfato y heparán sulfato.
Proteoglucanos
Un proteoglucano es una molécula compuesta por la unión covalente entre una cadena de aminoácidos y uno o varios glucosaminoglucanos sulfatados.
Es una familia de moléculas ubicua. Los proteoglucanos son sintetizados en el interior celular. La parte proteica se sintetiza en el retículo endoplasmático, donde también se inicia la adición de glúcidos. Sin embargo, la elongación de las cadenas de repeticiones de glucosaminoglucanos y la sulfatación se produce en el lado trans del aparato de Golgi.
La mayoría de los proteoglucanos son exocitados al espacio intercelular, pero algunos formarán parte de la membrana plasmática gracias que su parte proteica contiene secuencias de aminoácidos hidrófobos que se insertan entre las cadenas de ácidos grasos de la membrana. Otras moléculas como el colágeno tipo IX, el XII y el XVII también contienen cadenas de glucosaminoglucanos.
Los proteoglucanos se diferencian sobre todo en la secuencia y en la longitud de la cadena de aminoácidos (desde 100 a 4000 aminoácidos). También se diferencian en el número y en el tipo de moléculas de glucosaminoglucanos que tiene unidos. Por ejemplo, la decorina tiene una sola molécula mientras que el agrecano contiene más de 200.
La función de los proteoglucanos depende de sus moléculas de glucosaminoglucanos: hidratación, resistencia a presiones mecánicas, lubricantes, afectan a la diferenciación, la movilidad y la fisiología celular, etcétera. Su acción mecánica es esencial en los cartílagos y en las articulaciones. Pero además son puntos de anclaje de las células a la matriz extracelular que le rodea, bien por su acción directa por ser moléculas integrales de la membrana plasmática, porque forman uniones con fosfolípidos de la membrana o porque son reconocidos por proteínas de adhesión presentes en las membranas plasmáticas como las integrinas.
Glucoproteínas.
Las distintas moléculas que forman la matriz extracelular están unidas entre sí para formar un entramado cohesionado. De igual modo, las células están adheridas a las moléculas de la matriz extracelular. La mayoría de estas uniones son entre proteínas, pero también entre proteínas y azúcares, y están principalmente mediadas por glucoproteínas. Hay tres tipos de uniones que dan cohesión a los tejidos: entre moléculas de la matriz extracelular, entre las células y la matriz extracelular y entre células contiguas.
Complejo de unión
Los complejos de unión se clasifican según su forma, las moléculas de adhesión que los componen, los elementos a los que se unen y sus interacciones con el citoesqueleto.
- Las uniones estrechas o zonula occludens se encuentran en las partes apicales de los epitelios y en el tejido muscular cardiaco. Establecen uniones tan fuertes y estrechas entre las células contiguas que prácticamente no dejan espacio intercelular entre sus membranas plasmáticas, limitando la difusión de sustancia solubles extracelulares. Las uniones estrechas forman una especie de cinturón que rodea todo el perímetro celular, en el caso de las células epiteliales. Además de mantener cohesionadas fuertemente a las células realizan otras funciones.
- Las uniones adherentes o zonula adherens son complejos de unión que se forman en las células epiteliales y que se sitúan próximas y basales a las uniones estrechas. Su misión es unir células vecinas. Son los primeros complejos de unión que se forman durante el desarrollo de los epitelios, aparece antes que las uniones estrechas, por lo que parecen actuar en procesos morfogenéticos durante el desarrollo embrionario.
- Los desmosomas o macula adherens, al contrario que los dos complejos de unión anteriores, establecen conexiones puntuales en forma de disco entre células vecinas, como si fuesen remaches. Son muy abundantes entre las células epiteliales y entre las musculares, pero también en otros tejidos como el nervioso. Las uniones entre células están mediadas por moléculas del tipo cadherinas denominadas desmogleínas y desmocolinas. El dominio intracelular de estas cadherinas contacta con los filamentos intermedios como las queratinas, gracias a proteínas intermediarias.
- Los hemidesmosomas y las uniones focales establecen uniones fuertes entre las células y la matriz extracelular. En ambos casos las uniones se establecen por integrinas. Los hemidesmosomas unen las células epiteliales a la lámina basal gracias al dominio extracelular de la integrina, mientras que el dominio intracelular contacta con los filamentos intermedios citosólicos. Aunque los hemidesmosomas parecen desmosomas sin una de sus partes, molecularmente son diferentes. Las uniones focales unen a las células con diversos tipos de matrices extracelulares gracias a otro tipo de integrinas que en su dominio intracelular contacta con los filamentos de actina.
Tipos
- La pared celular: contiene muchos azúcares, sobre todo glucosa formando celulosa.
- La lámina basal: contiene colágeno y laminina formando una malla.
- El cartílago: contiene una gran cantidad de glucosaminoglucanos para resistir presiones y fuerzas mecánicas.
- El hueso: posee colágeno tipo I que aporta elasticidad y precipitados de calcio que aporta dureza.
Fuentes
- Heino J. The collagen family members as cell adhesion proteins. Bioessays. 2007. 29:1001-1010.
- Canty EG, Kadler KE. Procollagen trafficking, processing and fibrillogenesis. Journal of cell sciences. 2005. 118:1341-1353.
- Kadler CM, et al.,. Collagens at a glance. Journal of cell science. 2007. 120:1955-1958.
- Kielty CM. Elastic fibres in health and disease. Expert reviews in molecular medicine. 2006. 8:1-23.