Diferencia entre revisiones de «Pentóxido de Dinitrógeno»
(→Obtención) |
m (Texto reemplazado: «<div align="justify">» por «») |
||
| (No se muestran 7 ediciones intermedias de 4 usuarios) | |||
| Línea 5: | Línea 5: | ||
|concepto=También conocido óxido de nitrógeno (V), anhídrido nítrico, es la forma más altamente ionizada de óxido de nitrógeno, se presenta en estado sólido y es de color blanco. | |concepto=También conocido óxido de nitrógeno (V), anhídrido nítrico, es la forma más altamente ionizada de óxido de nitrógeno, se presenta en estado sólido y es de color blanco. | ||
}} | }} | ||
| − | + | ||
''' Pentóxido de dinitrógeno ''' según nomenclatura sistemática. Su fórmula química es '''(N<sub>2</sub>O<sub>5</sub>)''', también conocido por la nomenclatura de stock como óxido de nitrógeno (V), y por la nomenclatura tradicional como anhídrido nítrico, posee número de oxidación +5. A excepción de los demás óxidos de [[Nitrógeno]], que se encuentran en estado gaseoso, éste se presenta en estado sólido, posee característica de ácido débil, puede explotar sin causa externa aparente. Su importancia se encuentra en el hecho de que puede reaccionar en una solución, así como en la fase gaseosa.</div> | ''' Pentóxido de dinitrógeno ''' según nomenclatura sistemática. Su fórmula química es '''(N<sub>2</sub>O<sub>5</sub>)''', también conocido por la nomenclatura de stock como óxido de nitrógeno (V), y por la nomenclatura tradicional como anhídrido nítrico, posee número de oxidación +5. A excepción de los demás óxidos de [[Nitrógeno]], que se encuentran en estado gaseoso, éste se presenta en estado sólido, posee característica de ácido débil, puede explotar sin causa externa aparente. Su importancia se encuentra en el hecho de que puede reaccionar en una solución, así como en la fase gaseosa.</div> | ||
| Línea 12: | Línea 12: | ||
Puede describirse como anhidrido de ácido- es el óxido obtenido eliminando agua de un oxoácido-<br/><center>2 HNO<sub>3</sub>2 HNO<sub>3</sub> = N<sub>2</sub> O<sub>5</sub> + H<sub>2</sub>O ></center> | Puede describirse como anhidrido de ácido- es el óxido obtenido eliminando agua de un oxoácido-<br/><center>2 HNO<sub>3</sub>2 HNO<sub>3</sub> = N<sub>2</sub> O<sub>5</sub> + H<sub>2</sub>O ></center> | ||
== Estructura == | == Estructura == | ||
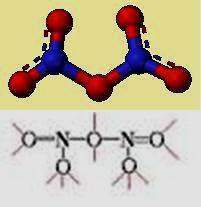
| − | Su estructura se forma por eliminación de agua del ácido nítrico, constituye un interesante ejemplo de una sustancia cuya unidad estructural molecular es diferente en estado sólido y en fase gaseosa<br/>En fase gaseosa está constituido por moléculas covalentes, por el contrario los estudios ópticos y con rayos X muestran que el sólido blanco es un compuesto iónico integrado por iones nitronio(NO2) <sup>+</sup> e iones nitrato(NO3) <sup>-</sup> . La experimentación indica que el N<sub>2</sub> O<sub>5</sub> debe ser el compuesto iónico "nitrato de nitronio", (NO2) <sup>+</sup> (NO3) <sup>-</sup> . El ion nitronio es isoelectrónico con el [[dióxido de carbono]] y el [[dióxido de dinitrógeno]],tiene una estructura AX<sub>2</sub> lineal (O-N-O). El ion nitrato es isoelectrónico con el [[monóxido de carbono]] y el fluoruro de boro y tiene la estructura trigonal plana; pero su elevada volatilidad demuestra que el cristal iónico, pasa fácilmente a moléculas covalentes al estado gaseoso. | + | Su estructura se forma por eliminación de agua del ácido nítrico, constituye un interesante ejemplo de una sustancia cuya unidad estructural molecular es diferente en estado sólido y en fase gaseosa<br/>En fase gaseosa está constituido por moléculas covalentes, por el contrario los estudios ópticos y con rayos X muestran que el sólido blanco es un compuesto iónico integrado por iones nitronio(NO2) <sup>+</sup> e iones nitrato(NO3) <sup>-</sup> . La experimentación indica que el N<sub>2</sub> O<sub>5</sub> debe ser el compuesto iónico "nitrato de nitronio", (NO2) <sup>+</sup> (NO3) <sup>-</sup> . El ion nitronio es isoelectrónico con el [[dióxido de carbono]] y el [[dióxido de dinitrógeno]],tiene una estructura AX<sub>2</sub> lineal (O-N-O). El ion nitrato es isoelectrónico con el [[Monóxido de Carbono|monóxido de carbono]] y el fluoruro de boro y tiene la estructura trigonal plana; pero su elevada volatilidad demuestra que el cristal iónico, pasa fácilmente a moléculas covalentes al estado gaseoso. |
| + | |||
== Obtención == | == Obtención == | ||
Se obtiene por deshidratación del ácido nítrico al 100% con pentóxido de difósforo (P<sub>4</sub> O<sub>10</sub>)<br/><center> 4HNO<sub>3</sub>(l) + P<sub>4</sub> O<sub>10</sub>(s) = 2N<sub>2</sub> O<sub>5</sub>(s) + 4HPO<sub>3</sub>(l) </center> <br/>, o bien por acción del di[[cloro]] sobre el nitrato de plata a 60°C <br/><center> 2Cl<sub>2</sub>(l) + AgNO<sub>3</sub>(ac) = 2N<sub>2</sub> O<sub>5</sub>(s) + AgCl(ac) + O<sub>2</sub>(g) a 60°C </center><br/> | Se obtiene por deshidratación del ácido nítrico al 100% con pentóxido de difósforo (P<sub>4</sub> O<sub>10</sub>)<br/><center> 4HNO<sub>3</sub>(l) + P<sub>4</sub> O<sub>10</sub>(s) = 2N<sub>2</sub> O<sub>5</sub>(s) + 4HPO<sub>3</sub>(l) </center> <br/>, o bien por acción del di[[cloro]] sobre el nitrato de plata a 60°C <br/><center> 2Cl<sub>2</sub>(l) + AgNO<sub>3</sub>(ac) = 2N<sub>2</sub> O<sub>5</sub>(s) + AgCl(ac) + O<sub>2</sub>(g) a 60°C </center><br/> | ||
| Línea 21: | Línea 22: | ||
El pentóxido de dinitrógeno es altamente reactivo, y forma ácido nítrico (HNO3) cuando se descompone en el agua. <br/><center>N<sub>2</sub> O<sub>5</sub> + H<sub>2</sub>O = 2 HNO<sub>3</sub></center><br/> es la forma más altamente ionizada de óxido de nitrógeno, lo que le infiere una gran capacidad de combustión.<br/> Se descompone lentamente a temperatura ambiente para obtener [[dióxido de nitrógeno]] y di[[Oxígeno]]<br/><center>2N<sub>2</sub> O<sub>5</sub>(s) = 4NO<sub>2</sub>(l) + O<sub>2</sub>(g) </center><br/> | El pentóxido de dinitrógeno es altamente reactivo, y forma ácido nítrico (HNO3) cuando se descompone en el agua. <br/><center>N<sub>2</sub> O<sub>5</sub> + H<sub>2</sub>O = 2 HNO<sub>3</sub></center><br/> es la forma más altamente ionizada de óxido de nitrógeno, lo que le infiere una gran capacidad de combustión.<br/> Se descompone lentamente a temperatura ambiente para obtener [[dióxido de nitrógeno]] y di[[Oxígeno]]<br/><center>2N<sub>2</sub> O<sub>5</sub>(s) = 4NO<sub>2</sub>(l) + O<sub>2</sub>(g) </center><br/> | ||
=== Mecanismo de descomposición === | === Mecanismo de descomposición === | ||
| − | El mecanismo de descomposición del pentóxido de dinitrógeno implica al trióxido de nitrógeno transitorio(NO<sub>3</sub>). En el primer paso de la descomposición el N<sub>2</sub> O<sub>5</sub> está en equilibrio con el [[dióxido de nitrógeno]] (NO<sub>2</sub>) y trióxido de nitrógeno (NO<sub>3</sub>)<br/><center>1.- N<sub>2</sub> O<sub>5</sub> = 2NO<sub>2</sub> + NO<sub>3</sub> (equilibrio rápido)</center><br/>Algunas colisiones entre el NO<sub>2</sub> y trióxido de nitrógeno NO<sub>3</sub>, conducen a la formación de una molécula de di[[Oxígeno]]( O<sub>2</sub>):>)<br/><center>2.- NO<sub>2</sub> + NO<sub>3</sub> | + | El mecanismo de descomposición del pentóxido de dinitrógeno implica al trióxido de nitrógeno transitorio(NO<sub>3</sub>). En el primer paso de la descomposición el N<sub>2</sub> O<sub>5</sub> está en equilibrio con el [[dióxido de nitrógeno]] (NO<sub>2</sub>) y trióxido de nitrógeno (NO<sub>3</sub>)<br/><center>1.- N<sub>2</sub> O<sub>5</sub> = 2NO<sub>2</sub> + NO<sub>3</sub> (equilibrio rápido)</center><br/>Algunas colisiones entre el NO<sub>2</sub> y trióxido de nitrógeno NO<sub>3</sub>, conducen a la formación de una molécula de di[[Oxígeno]]( O<sub>2</sub>):>)<br/> |
| + | <center>2.- NO<sub>2</sub> + NO<sub>3</sub> = NO<sub>2</sub> + NO + O<sub>2</sub> (lento)</center><br/>Una representación más detallada de este paso es <br/> | ||
| + | >[[Imagen: Mecanismo_de_descomposición.jpg|thumb|center|]] | ||
| + | |||
== Utilización == | == Utilización == | ||
Conocido también como anhídrido nitroso, que es un agente nitrante excelente, y se utiliza para la síntesis de la mayoría de los materiales energéticos, que se obtienen por la nitración de una variedad de sustratos tales como compuestos aromáticos, alcanos, alquenos, alcoholes, azúcares , oximas, aminas y amidas. | Conocido también como anhídrido nitroso, que es un agente nitrante excelente, y se utiliza para la síntesis de la mayoría de los materiales energéticos, que se obtienen por la nitración de una variedad de sustratos tales como compuestos aromáticos, alcanos, alquenos, alcoholes, azúcares , oximas, aminas y amidas. | ||
última versión al 20:38 13 ago 2019
Pentóxido de dinitrógeno según nomenclatura sistemática. Su fórmula química es (N2O5), también conocido por la nomenclatura de stock como óxido de nitrógeno (V), y por la nomenclatura tradicional como anhídrido nítrico, posee número de oxidación +5. A excepción de los demás óxidos de Nitrógeno, que se encuentran en estado gaseoso, éste se presenta en estado sólido, posee característica de ácido débil, puede explotar sin causa externa aparente. Su importancia se encuentra en el hecho de que puede reaccionar en una solución, así como en la fase gaseosa.
Sumario
Propiedades físicas
El pentóxido de dinitrógeno, de masa molar 108,01 g/mol, es un compuesto sólido de color blanco, funde a 30,0°C, es estable a temperaturas inferiores a los 8°C, y además debe estar en ausencia de luz solar. En estado de elevada pureza, forma cristales duros, incoloros delicuescentes al aire.
Puede describirse como anhidrido de ácido- es el óxido obtenido eliminando agua de un oxoácido-
Estructura
Su estructura se forma por eliminación de agua del ácido nítrico, constituye un interesante ejemplo de una sustancia cuya unidad estructural molecular es diferente en estado sólido y en fase gaseosa
En fase gaseosa está constituido por moléculas covalentes, por el contrario los estudios ópticos y con rayos X muestran que el sólido blanco es un compuesto iónico integrado por iones nitronio(NO2) + e iones nitrato(NO3) - . La experimentación indica que el N2 O5 debe ser el compuesto iónico "nitrato de nitronio", (NO2) + (NO3) - . El ion nitronio es isoelectrónico con el dióxido de carbono y el dióxido de dinitrógeno,tiene una estructura AX2 lineal (O-N-O). El ion nitrato es isoelectrónico con el monóxido de carbono y el fluoruro de boro y tiene la estructura trigonal plana; pero su elevada volatilidad demuestra que el cristal iónico, pasa fácilmente a moléculas covalentes al estado gaseoso.
Obtención
Se obtiene por deshidratación del ácido nítrico al 100% con pentóxido de difósforo (P4 O10)
, o bien por acción del dicloro sobre el nitrato de plata a 60°C
Fuente natural de obtención
Es generado en el aire en una concentración muy baja, a menos que sea emitido por algún proceso (tal como una instalación productora de ácido nítrico) que esté diseñada específicamente para generarlo.
Propiedades químicas
El pentóxido de dinitrógeno es altamente reactivo, y forma ácido nítrico (HNO3) cuando se descompone en el agua.
es la forma más altamente ionizada de óxido de nitrógeno, lo que le infiere una gran capacidad de combustión.
Se descompone lentamente a temperatura ambiente para obtener dióxido de nitrógeno y diOxígeno
Mecanismo de descomposición
El mecanismo de descomposición del pentóxido de dinitrógeno implica al trióxido de nitrógeno transitorio(NO3). En el primer paso de la descomposición el N2 O5 está en equilibrio con el dióxido de nitrógeno (NO2) y trióxido de nitrógeno (NO3)
Algunas colisiones entre el NO2 y trióxido de nitrógeno NO3, conducen a la formación de una molécula de diOxígeno( O2):>)
Una representación más detallada de este paso es
>
Utilización
Conocido también como anhídrido nitroso, que es un agente nitrante excelente, y se utiliza para la síntesis de la mayoría de los materiales energéticos, que se obtienen por la nitración de una variedad de sustratos tales como compuestos aromáticos, alcanos, alquenos, alcoholes, azúcares , oximas, aminas y amidas.
Referencias
- Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
- Mahan, B.H: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1975.
Fuentes
Enlace externo