Síndrome de distrés respiratorio del adulto
| ||||||||
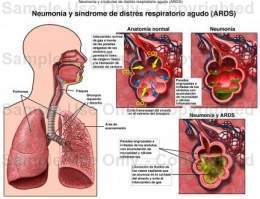
Síndrome de distrés respiratorio del adulto. Insuficiencia respiratoria causada por diversas lesiones pulmonares agudas, que se caracteriza por edema pulmonar no cardiogénico, dificultad respiratoria (distrés) e hipoxemia.
Sumario
Etiología
El síndrome del distrés respiratorio del adulto (SDRA), una urgencia médica frecuente, es precipitado por diversos procesos agudos que lesionan de forma directa o indirecta el pulmón, como la sepsis, las neumonías virales o bacterianas primarias, la aspiración del contenido gástrico, los traumatismos torácicos directos, el shock profundo o prolongado, las quemaduras, la embolia grasa, el ahogamiento por inmersión, la transfusión masiva de sangre, la derivación cardiopulmonar, la toxicidad por O2, la pancreatitis hemorrágica aguda, la inhalación de humo u otros gases tóxicos y la ingesta de ciertos fármacos. Se calcula que la incidencia de SDRA es >30% en la sepsis. Aunque se denomina "del adulto", este síndrome también puede afectar a los niños.
Fisiopatología
Se entiende mal la lesión pulmonar inicial. Los estudios en animales sugieren que se acumulan plaquetas y leucocitos activados en los capilares, el intersticio y los espacios aéreos, que pueden liberar prostaglandinas, radicales tóxicos de O2, enzimas proteolíticas y otros mediadores (como el factor de necrosis tumoral y las interleucinas), que lesionan las células, facilitan la inflamación y la fibrosis y modifican el tono broncomotor y la reactividad vascular.
Cuando se lesionan los capilares pulmonares y los epitelios alveolares, se produce la salida de sangre y plasma hacia los espacios intersticial e intraalveolar, con la consiguiente ocupación alveolar por líquido y atelectasias, estas últimas debidas en parte a la menor actividad surfactante. La lesión no es homogénea y afecta de manera predominante a las zonas declives del pulmón. En 2 o 3 días se produce inflamación intersticial y broncoalveolar con proliferación de las células epiteliales e intersticiales. Se acumula con rapidez colágeno, produciendo una fibrosis intersticial grave en 2 o 3 semanas. Estos cambios patológicos originan una reducción de la distensibilidad pulmonar, con menor capacidad residual funcional, alteraciones en la relación ventilación/perfusión, aumento del espacio muerto fisiológico, hipoxemia grave e hipertensión pulmonar.
Signos, síntomas y diagnóstico
El SDRA se suele desarrollar en 24 a 48 h tras la lesión o enfermedad inicial. Primero se produce disnea, que se suele acompañar de una respiración rápida y superficial. Se puede observar retracción intercostal y suprasternal con la inspiración. La piel puede aparecer cianótica o moteada y no mejora al administrar O2. La auscultación puede detectar roncus, sibilancias o estertores, pero en ocasiones es normal.
El diagnóstico precoz exige un alto índice de sospecha ante la presencia de disnea en situaciones que predisponen al SDRA. Se puede realizar el diagnóstico de presunción con la gasometría arterial y la radiografía de tórax. Este análisis demuestra inicialmente una alcalosis respiratoria aguda: una PaO2 muy baja, con una PaCO2 normal o baja y un pH elevado. La radiología de tórax suele mostrar infiltrados alveolares difusos bilaterales parecidos al edema pulmonar agudo de origen cardíaco, pero la silueta cardíaca suele ser normal. Sin embargo, las alteraciones radiológicas suelen mostrar varias horas de desfase respecto a las alteraciones funcionales, de manera que la hipoxemia puede parecer desproporcionadamente grave en comparación con el edema radiológico. Se suele mantener una PaO2 extremadamente baja a pesar de las concentraciones elevadas de O2 inspirado (FiO2), lo que indica la existencia de una derivación derecha-izquierda a través de las unidades consolidadas y atelectásicas no ventiladas.
Tras el tratamiento inmediato de la hipoxemia están indicados varios pasos para el diagnóstico. Cuando existen dudas de que el paciente se encuentre en insuficiencia cardíaca, un catéter de Swan-Ganz puede resultar útil. La presión de enclavamiento arterial pulmonar es típicamente baja (<18 mm Hg) en el SDRA y alta (>20 mm Hg) en la insuficiencia cardíaca. Si se considera posible un embolismo pulmonar, que se puede parecer al SDRA, se deben realizar procedimientos diagnósticos adecuados (como la angiografía pulmonar) después de estabilizar al paciente. La neumonía por Pneumocystis carinii y en ocasiones otras infecciones pulmonares primarias pueden parecerse al SDRA y se deben plantear en los pacientes inmunosuprimidos; en estos casos puede resultar útil la biopsia pulmonar o el lavado broncoalveolar guiado por broncoscopia.
La American-European Consensus Conference define el SDRA como PaO2/FiO2 <200 (independientemente de la presión positiva al final de la espiración), la infiltración bilateral en la radiología frontal de tórax y la PAWP £18 mm Hg cuando se mide o no existen evidencias de hipertensión auricular izquierda.
Complicaciones y pronóstico
La sobreinfección bacteriana secundaria de los pulmones, sobre todo por bacterias aerobias gramnegativas (como Klebsiella, Pseudomonas y Proteus spp.) y por Staphylococcus aureus grampositivos, especialmente las cepas meticilín-resistentes; se puede producir insuficiencia multiorgánica, sobre todo insuficiencia renal, y complicaciones debidas a las técnicas de soporte vital, que se asocian con una elevada mortalidad y morbilidad. Se puede producir de forma súbita un neumotórax a tensión asociado con la colocación de catéteres venosos centrales o con la ventilación por presión positiva (PPV) y presión positiva al final de la espiración (PEEP), cuyo reconocimiento y tratamiento precoces resultan fundamentales para evitar la muerte. El neumotórax se debe sospechar ante una taquicardia, una hipotensión y un aumento súbito en la presión inspiratoria pico necesaria para la ventilación mecánica. El neumotórax que aparece en fases tardías del SDRA se considera un signo ominoso porque se suele asociar con una lesión pulmonar grave y con necesidad de elevadas presiones ventilatorias. Si no se realiza una reposición adecuada del volumen intravascular, la PPV y la PEEP pueden reducir el retorno venoso, disminuyendo el gasto cardíaco y el transporte global de O2 a los tejidos, lo que contribuye al fallo multiorgánico secundario.
La tasa de supervivencia de los pacientes con SDRA grave que reciben un tratamiento correcto es de un 60%; si la hipoxemia grave del SDRA no se reconoce y trata, se produce una parada cardiopulmonar en un 90% de los pacientes. Los que responden con rapidez al tratamiento suelen desarrollar una disfunción pulmonar residual o discapacidad mínima o nulas. Los pacientes que precisan un soporte ventilatorio prolongado con FiO2 >50% pueden desarrollar con más frecuencia una fibrosis pulmonar. En la mayoría de los pacientes que sobreviven a la enfermedad aguda, la fibrosis pulmonar suele resolverse en meses, aunque se desconoce por qué mecanismos.
Tratamiento
Los principios del tratamiento son parecidos cualquiera que sea la causa. Se debe mantener la oxigenación y corregir la causa de lesión pulmonar aguda subyacente. Hace falta una atención meticulosa para poder evitar la depleción nutricional, la toxicidad por O2, la sobreinfección, el barotrauma y la insuficiencia renal, que se pueden ver agravados por la depleción de volumen intravascular. Mientras se descarta el diagnóstico, se debe tratar la hipoxemia que amenaza la vida con una FiO2 elevada y controlarla con gasometrías seriadas u oximetrías no invasivas. Puede ser necesaria la intubación endotraqueal con ventilación mecánica y la PEEP para suministrar el O2, dado que la hipoxemia suele ser refractaria a la inhalación de O2 en mascarilla facial.
El volumen intravascular suele estar deplecionado cuando comienza el SDRA, porque la sepsis es una de las causas asociadas, debido a que se administró tratamiento con diuréticos antes de sospechar este diagnóstico o porque el inicio de la PPV reduce el retorno venoso. A pesar de la existencia de edema alveolar, se deben administrar líquidos i.v. si son necesarios para recuperar la perfusión periférica, la excreción de orina y la TA. Resulta fundamental controlar el volumen vascular porque tanto la hipovolemia como la sobrehidratación resultan peligrosas. Los hallazgos físicos y los valores de presión venosa central pueden ser confusos en los pacientes críticos sometidos a ventilación mecánica y, si persiste la hipoxemia grave, si la perfusión de la piel es mala, si se altera el estado mental o si se reduce la excreción de orina (<0,5 ml/kg/h), se necesita de inmediato un índice fiable de volumen intravascular. Se suele emplear un catéter de Swan-Ganz para determinar la infusión de volumen, sobre todo si se necesita PEEP. Sin embargo, estos catéteres conllevan riesgos. Para realizar el aporte de líquidos resulta esencial vigilar de forma estrecha la ingesta y la excreción de los mismos. En general, los pacientes con SDRA responden mejor cuando se opta por un tratamiento "seco", es decir, restricción de líquidos con uso juicioso de diuréticos, siempre que no se alteren el gasto cardíaco y la perfusión tisular.
Si la sepsis es la causa del SDRA o puede serlo, se debe iniciar el tratamiento antibiótico empírico hasta que lleguen los resultados de los cultivos. Los cultivos y la tinción de Gram del esputo o los aspirados traqueales pueden ayudar a detectar de forma precoz la sobreinfección pulmonar y determinar la antibioterapia. Se deben drenar las infecciones en espacios cerrados. La alimentación se inicia a las 48 a 72 h, siendo preferible la vía enteral porque protege el revestimiento mucoso intestinal.
Los esteroides no producen ningún efecto beneficioso demostrado en el SDRA agudo, aunque existen comunicaciones aisladas que sugieren cierto beneficio en los pacientes con SDRA en la fase fibroproliferativa tardía, que se desarrolla a los 7 a 10 d de ventilación mecánica. Se debe excluir en estos pacientes la coexistencia de infecciones pulmonares, ya que suelen estar febriles y tienen leucocitosis con infección o sin ella.
Muchos abordajes terapéuticos y profilácticos del SDRA han resultados infructuosos o poco útiles. Entre los tratamientos que no han mejorado o prevenido el SDRA se encuentran los anticuerpos monoclonales contra la endotoxina, los anticuerpos monoclonales contra el factor de necrosis tumoral, el antagonista del receptor de la interleucina 1, la PEEP profiláctica (precoz), la oxigenación con membrana extracorpórea y la extracción extracorpórea de CO2, la albúmina i.v., la expansión de volumen y los fármacos cardiotónicos para aumentar la distribución sistémica de O2, los esteroides en las fases iniciales del SDRA, el ibuprofeno parenteral para inhibir la ciclooxigenasa, la prostaglandina E1 y la pentoxifilina. Algunos enfoques parecen prometedores, pero necesitan más estudios.
La postura en decúbito prono puede mejorar de forma notable la oxigenación en algunos pacientes, posiblemente porque esta postura deriva la perfusión y el intercambio de gases hacia zonas más normales, que previamente no estaban declives. Sin embargo, no está claro si esta postura mejora el intercambio de gases en el SDRA grave y si puede reducir la duración de la ventilación mecánica y mejorar la supervivencia global. Resulta difícil colocar al paciente.
La inhalación de óxido nítrico mejora de forma significativa la hipertensión pulmonar y la oxigenación arterial en los pacientes con SDRA grave sin producir hipotensión sistémica. Todavía hay que demostrar si el óxido nítrico mejora la supervivencia y si su uso prolongado determina más daño pulmonar por los productos de degradación derivados del mismo, como el anión peroxinitrito.
El ketoconazol puede prevenir el SDRA suprimiendo la formación y liberación del factor de necrosis tumoral en los macrófagos. Su efecto beneficioso en estudios preliminares pequeños tiene que ser confirmado en estudios bien controlados más amplios. Los estudios iniciales con surfactante sintético en aerosol en pacientes adultos con SDRA han resultado poco alentadores. El desarrollo de dispositivos de administración de aerosoles de mejor calidad y los preparados de surfactante natural de mamífero pueden mejorar la estabilidad alveolar, reducir las atelectasias y la derivación intrapulmonar de sangre y aumentar las propiedades antibacterianas y antiinflamatorias del líquido que reviste los alvéolos; en el momento actual se están desarrollando estudios sobre estos tratamientos.
Ventilación mecánica
La mayor parte de los pacientes necesitan intubación endotraqueal y ventilación asistida con un ventilador mecánico limitado por volumen. Se debe plantear la intubación endotraqueal y la PPV cuando la frecuencia respiratoria sea >30 respiraciones/min o si se necesita una FiO2 con mascarilla facial >60% para mantener la Po2 en unos 70 mm Hg durante varias horas. Como alternativa a la intubación, una mascarilla de presión positiva en la vía aérea puede aportar PEEP de forma eficaz a los pacientes con SDRA moderado o leve. Dichas mascarillas no se recomiendan para los pacientes con niveles bajos de consciencia, dado el riesgo de aspiración, y deben ser sustituidas por un ventilador si el paciente evoluciona a un SDRA grave o muestra signos de fatiga de los músculos respiratorios con aumento de la frecuencia respiratoria y de la Pco2 arterial.
Los valores convencionales para un ventilador limitado por volumen en el SDRA son un volumen corriente de 10 a 15 ml/kg, una PEEP de 5 a 10 cm H2O, una FiO2 £60% y frecuencia mixta asistida/controlada modo de control-activada por el paciente. Esta técnica puede sustituirse por una ventilación mandatoria intermitente con una frecuencia respiratoria inicial de 10 a 12 respiraciones/min con PEEP.
Existe preocupación sobre si los elevados volúmenes y presiones del ventilador pueden agravar las lesiones pulmonares en el SDRA, aunque no se ha demostrado este efecto. Una PEEP demasiado baja también puede lesionar el pulmón, ya que permite que las unidades pulmonares terminales inestables se abran y cierren de forma repetida. Este problema se puede evitar con volúmenes corrientes pequeños (6 a 8 ml/kg) y PEEP más elevada (entre 10 y 18 cm H2O).
El objetivo de los volúmenes corrientes bajos es evitar que las respiraciones generadas por el ventilador superen el punto de inflexión superior (deflexión) de la curva presión-volumen del paciente y que causen una sobredistensión pulmonar (v. fig. 67-1 ). Pasado este punto, el pulmón se vuelve bastante rígido y pequeños aumentos en el volumen corriente determinan grandes aumentos en la presión meseta del ventilador (la presión necesaria para mantener la insuflación del pulmón y la pared torácica cuando ha terminado el flujo inspiratorio). Por razones técnicas, el punto de inflexión superior no se suele medir de forma directa, sino que se suele determinar la presión meseta del ventilador, que en la mayoría de los pacientes no debe superar 25 a 30 cm H2O (o 20 a 25 cm H2O según algunos investigadores). Con un volumen corriente bajo se puede aumentar la frecuencia respiratoria del ventilador para mantener un pH y una PCO2 arteriales adecuados. Algunos pacientes desarrollan a pesar de todo hipercapnia y acidosis respiratoria, que suelen tolerar bien. Si el pH arterial desciende por debajo de 7,2, se puede empezar la infusión lenta de bicarbonato.
Teóricamente la PEEP seleccionada debe ser varios centímetros de agua superior al punto de inflexión inferior de la curva presión-volumen del paciente para facilitar la incorporación e insuflación de muchos alvéolos. Si no se determina directamente este punto de inflexión inferior, suele bastar con una PEEP de 10 a 15 cm de H2O. Con una PEEP satisfactoria, la FiO2 del ventilador se puede reducir con seguridad a <50 a 60%, de forma que el paciente tenga una PaO2 60 mm Hg o una saturación arterial de O2 (SaO2) 90%. Para que el transporte de O2 a los tejidos sea adecuado, el índice cardíaco debe ser 3 l/ min/m2; en ocasiones es necesaria la reposición de volumen o la administración de fármacos cardiotónicos parenterales.
Como alternativa se puede emplear la ventilación mecánica controlada por presión, sobre todo en pacientes con SDRA grave. Se seleccionan la presión y duración de la inspiración y se modifica el volumen corriente con la impedancia inspiratoria; se evitan de este modo las presiones inspiratorias altas en el ventilador, pero se suele producir una hipercapnia. Este abordaje se suele combinar con una ventilación de cociente inverso, en la que se selecciona que la duración de la inspiración sea igual o mayor que la de la espiración. Esta técnica pone en funcionamiento y reexpande más unidades pulmonares que la PEEP sola (en parte porque produce una PEEP intrínseca o auto-PEEP), de forma que se puede reducir todavía más un valor de FiO2 potencialmente perjudicial. Esta técnica es incómoda y exige la sedación del paciente y la administración de fármacos que paralicen los músculos.
La facilidad de retirada de la ventilación se basa en la evidencia continuada de mejora de la función pulmonar (menor necesidad de O2 y PEEP), la mejora radiológica y la resolución de la taquipnea. Se puede retirar a los pacientes del ventilador sin enfermedad pulmonar previa con facilidad y las dificultades para hacerlo indican infección reciente o no tratada, excesiva hidratación, broncospasmo, anemia, alteraciones electrolíticas, disfunción cardíaca o mal estado nutricional que producen debilidad muscular respiratoria. Si se tratan estas enfermedades, se puede conseguir retirar el ventilador empleando una ventilación mandatoria intermitente para reducir la frecuencia mecánica, a menudo con cierto grado de ventilación de soporte con presión o mediante intentos de respiración espontánea durante períodos cada vez más largos a través de una pieza en T conectada con el tubo endotraqueal. Se suele mantener una PEEP baja (5 cm H2O) durante todo el proceso de retirada del ventilador.
Fuentes
- Manual Merck Décima Edición