Uracilo
| ||||
Uracilo
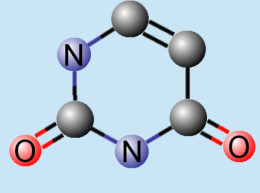
El uracilo es una pirimidina, una de las cinco bases nitrogenadas que forman parte del ARN y en el código genético se representa con la letra U. Su fórmula molecular es C4H4N2O2.[1] El uracilo reemplaza en el ARN a la timina que es una de las cuatro bases nitrogenadas que forman el ADN. Al igual que la timina, el uracilo siempre se empareja con la adenina mediante dos puentes de hidrógeno, pero le falta el grupo metilo. Forma el nucleósido uridina (Urd) y el nucleótido uridilato (UMP). El uracilo fue descubierto originalmente en el año 1900. Fue aislado por hidrólisis del ácido ribonucleico de las levadura que se encontraron en ciertos órganos de bovinos: timo y bazo, así como en el esperma de los arenques y en el germen de trigo.[2] El uracilo es una molécula de estructura planar, insaturada y que posee la habilidad de absorber sustancias.
Propiedades
Se encuentra en el ARN, formando un par de bases con la adenina y siendo reemplazada por la timina en el ADN. La metilación del uracilo produce timina,[4] la cual, al ser más estable, protege al ADN y mejora la eficiencia de su replicación. El uracilo puede formar un par de bases con cualquiera de las bases dependiendo de como se disponga la Molécula en la doble hélice, pero lo forma más rápidamente con la adenina debido a su grupo metilo que es repelido en una posición fija.[4] Se ha comprobado que los pares de uracilo se unen con la adenosina a través de puentes de Hidrógeno.
El uracilo es aceptor de puentes de hidrógeno y puede formar dos de estos enlaces por cada molécula. El uracilo puede unirse también al Azúcar del esqueleto hidrocarbonado, la ribosa, formando un ribonucleósido, la uridina. Cuando un fosfato se une a la uridina, se genera uridina 5'-monofosfato.
Tautomería
El uracilo (U) posee una variante tautomérica en forma de amida-iminol que se produce gracias a su estructura resonante en los sustituyentes del Nitrógeno y del Oxígeno. Debido a la inestabilidad de la molécula, presenta alguna propiedad de aromaticidad que es compensada en parte con la estabilidad del ciclo-amídico. El tautómero ceto es habitualmente la estructura lactama, mientras que el tautómero enol es referido como la estructura lactima. Estas formas tautoméricas son predominantes ente un ambiente con pH igual a 7. La estructura lactama es la forma más común de uracilo.
El uracilo se recicla a si mismo para formar nucleótidos llevando a cabo una serie de reacciones de tipo fosforribosiltransferasa.La degradación del uracilo produce substratos, aspartato, dióxido de carbono y amoníaco.[5]
C4H4N2O2 → H3NCH2CH2COO- + NH4 + CO2
Síntesis
Existen muchas formas de sintetizar uracilo en el laboratorio. La primera reacción descrita es la más simple de todas ellas, añadiendo agua a la citosina para producir uracilo y amoníaco. La forma más común de producir uracilo es mediante la condensación del ácido maleico con urea en ácido sulfúrico fumante, tal y como se puede ver más abajo. El uracilo puede ser sintetizado por una doble descomposición del tiouracilo en ácido cloracético en medio acuoso.
C4H5N3O + H2O → C4H4N2O2 + NH3 C4H4O4 + CH4N2O → C4H4N2O2 + 2 H2O + CO La fotodehidrogenación del 5,6-diuracilo, que hace ser sintetizado como beta-alanina, reacciona con la urea, produciendo uracilo.[6]
Véase también
Fuentes
- ↑Garrett, Reginald H.; Grisham, Charles M. Principals of Biochemistry with a Human Focus. United States: Brooks/Cole Thomson Learning, 1997.
- ↑ a b c d Brown, D.J. Heterocyclic Compounds: Thy Pyrimidines. Vol 52. New York: Interscience, 1994.
- ↑ a b Horton, Robert H.; et al.Principles of Biochemistry. 3rd ed. Upper Saddle River, NJ: Prentice Hall, 2002.
- ↑ a b www.madsci.org
- ↑ a b c Garrett, Reginald H.; Grisham, Charles M. Principles of Biochemistry with a Human Focus. United States: Brooks/Cole Thomson Learning, 1997.
- ↑ Chittenden, G.J.F.; Schwartz, Alan W. Nature.263,(5575), 350-1.