Aciduria propiónica
| ||||
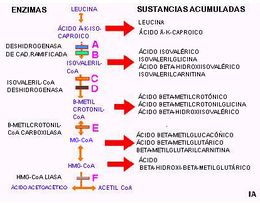
La acidemia propiónica (AP) es una enfermedad hereditaria, autosómica, recesiva ocasionada por un déficit de la enzima propionil CoA carboxilasa, es una aciduria orgánica causada por deficiencias en la actividad de la propionil CoA-carboxilasa, y se caracteriza por episodios potencialmente mortales de descompensación metabólica y disfunción. neurológica que se pueden complicar por miocardiopatía. Esta enzima se encuentra en las mitocondrias de la célula y sirve para catalizar la transformación de propionil CoA a metilmanolil CoA, este paso metabólico forma parte de la degradación de los aminoácidos valina, metionina, treonina e isoleucina, interviene también en la metabolización de aquellos ácidos grasos que tienen un número impar de átomos de carbono. La deficiencia de la actividad enzimática ocasiona una concentración elevado de propionato en orina y sangre. Este trastono se incluye dentro del grupo de enfermedades llamadas errores congénitos del metabolismo y su frecuencia es variable según la región, en Estados Unidos se presenta un caso por cada 35000 nacimientos, mientras que en Arabia Saudita afecta a 1 de cada 3000 nacidos. Se hereda de padres a hijos según un patrón autosómico recesivo, lo cual significa que los padres generalmente están sanos, no presentan el trastorno, pero son portadores y transmiten la anomalía a sus hijos. El niño debe recibir una copia del gen anómalo de cada progenitor para presentar la enfermedad. La acidemia propiónica puede manifestarse según diferentes patrones clínicos, pero la forma más habitual es la severa neonatal, en la que aparecen los síntomas en la primera semana de vida y se manifiesta por vómitos, perdida de peso, síntomas neurológicos, perdida de tono muscular y convulsiones, todo ello puede llevar al coma.En los exámenes de laboratorio se detecta acidosis metabólica y elevación de NH4+ en sangre (hiperamonemia).
Sumario
Epidemiología
La prevalencia es, probablemente, de 1 por cada 100.000 nacimientos vivos en todo el mundo. En algunos países, como Arabia Saudita, se observa una alta tasa de prevalencia.
Descripción clínica
La acidemia propiónica se puede presentar en una de las formas siguientes: inicio neonatal grave, inicio tardío intermitente o forma crónica progresiva. En la forma de aparición neonatal grave, los niños afectados presentan síntomas de intoxicación metabólica (mala alimentación, vómitos, sensorio alterado), y pancitopenia en un periodo que va de las pocas horas a las semanas después del nacimiento. En la forma de inicio tardío intermitente, la enfermedad se presenta después de un año o más de vida con episodios de descompensación metabólica provocada por periodos de respuesta catabólica a situaciones de estrés como fiebre, vómitos y traumatismos. Los pacientes también pueden presentar crisis neurológicas agudas caracterizadas por distonía, rigidez, coreoatetosis y demencia (debida al infarto de los ganglios basales). En la forma crónica progresiva, la enfermedad se presenta como retraso del crecimiento, vómitos crónicos, retraso psicomotor, hipotonía, convulsiones y trastornos del movimiento. Otras complicaciones conocidas son discapacidad intelectual, neuropatía óptica, miocardiopatía, síndrome de QT largo, pancreatitis, dermatitis y disfunción inmunitaria.
Etiología
La AP está causada por mutaciones en los genes PCCA (13q32) o PCCB (3q21-q22) que codifican las subunidades α y β de la propionil CoA-carboxilasa.
Métodos diagnósticos
Las pruebas de cribado ampliadas para recién nacidos identifican la AP al detectar un nivel elevado de propionilcarnitina. Se presentan casos sintomáticos durante la descompensación metabólica con acidosis, cetosis, aumento de la concentración aniónica, hiperlactatemia, hiperglicinemia, hiperamonemia, hipoglucemia y citopenias. El análisis de orina por cromatografía de gases-espectrometría de masas revela un patrón característico con 3-hidroxipropionato, metilcitrato, propionilglicina y propionilcarnitina que persiste entre crisis. La confirmación del diagnóstico se basa en la detección de deficiencias en la actividad enzimática o mutaciones en los genes PCCA o PCCB.
Diagnóstico diferencial
El diagnóstico diferencial incluye la sepsis neonatal, otras acidurias orgánicas de cadena ramificada, estenosis del píloro u otras causas comunes de acidosis por aumento de la concentración aniónica. En la forma crónica infantil, el retraso de crecimiento, los vómitos crónicos y la neutropenia pueden imitar la intolerancia a la leche de vaca, la enfermedad celiaca o deficiencias inmunitarias.
Diagnóstico prenatal
Se puede realizar un diagnóstico prenatal midiendo la propionilcarnitina, el metilcitrato y el 3-hidroxipropionato en el líquido amniótico o por análisis del DNA o análisis enzimático directo en familias con una mutación conocida.
Manejo y tratamiento
La confirmación del diagnóstico no es indispensable para empezar el tratamiento. La principal forma de tratamiento en una crisis es la inversión del catabolismo deteniendo la ingesta proteica y administrando calorías no proteicas en forma de líquidos intravenosos. La hiperamonemia se trata administrando benzoato de sodio, carbamilglutamato o por hemodiálisis. La regulación de la nutrición, en concreto la restricción proteica, es un elemento fundamental en el tratamiento a largo plazo de pacientes con AP. Se debe llevar un seguimiento regular del crecimiento. El complemento de carnitina ayuda en la desintoxicación. Evitar descompensaciones metabólicas y tratar con prontitud los episodios con el tratamiento estándar puede mejorar el rendimiento intelectual.
Pronóstico
La detección temprana y el tratamiento conllevan una reducción en la tasa de mortalidad durante el primer año de vida y una mejora de la tasa de supervivencia en la primera infancia y en la niñez, pero la morbilidad en términos de retraso en el desarrollo cognitivo sigue siendo alta. La cuestión de si se puede llevar a cabo un trasplante de hígado en la primera infancia para mejorar el pronóstico todavía se está investigando.