Amiloidosis
| ||||||
Amiloide y Amiloidosis. El nombre de Amiloide, dado por Virchow, se debe a la similitud con el almidón en cuanto a la afinidad tintorial con el yodo.
Sumario
Amiloide
Es un nombre genérico para designar diversas sustancias que tienen en común estar contituidas por proteína fibrilar plegada. Este tipo de estructura no ocurre normalmente en las proteínas de los mamíferos.
El depósito de amiloide es extracelular y corresponde siempre a una condición patológica, la amiloidosis, no rara vez progresiva y letal. El daño local principal que produce la infiltración amiloidea es la atrofia. Estos depósitos pueden ser localizados (en un órgano), o generalizados (en muchos órganos).
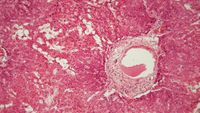
Las amiloidosis constituyen un grupo heterogéneo de enfermedades puesto que las cadenas polipeptídicas del amiloide tienen diversa composición de aminoácidos. Sin embargo, la estructura física del amiloide (figura 2.7) es similar en todas las sustancias amiloídeas conocidas.
Su componente principal es la fibrilla amiloídea, que está formada por dos filamentos helicoidales y que tiene 7 a 10 mm de diámetro. Las fibrillas amiloideas son visibles fácilmente al microscopio electrónico y aparecen dispuestas desordenamente. El amiloide tiene, además, el componente P, que es una glicoproteína, y el componente C, matriz amiloídea químicamente heterogénea.
De acuerdo con la secuencia aminoacídica de la fibrilla amiloidea, se distinguen diversos tipos de amiloide. En cada tipo se ha encontrado en el suero sanguíneo de los enfermos, una proteína precursora, que tiene la misma secuencia aminoacídica que la del amiloide del caso depositado en los tejidos.
En la nomenclatura actual los tipos de amiloide se designan abreviadamente, de la siguiente manera: S significa proteína sérica precursora; a continuación, A significa amiloide, y la letra que le sigue denota el tipo.
Los principales tipos son los siguientes: A (proteína A, obtenida de la fase aguda), L (cadena liviana de inmunoglobulina), F (familiar), E (endocrina) y S (senil). Así por ejemplo, SAL significa: proteína sérica precursora del amiloide de cadena liviana de inmunoglobulina.
Amiloidosis
La amiloidosis es una enfermedad causada por la acumulación del proteína amiloide en los espacios extracelulares de los tejidos y órganos del cuerpo. Esta proteína se genera en la médula ósea y se puede acumular en el corazón, el hígado, los riñones y otras partes del organismo. La amiloidosis es una enfermedad no muy habitual que no tiene cura aunque el tratamiento suele controlarla. En algunos casos, el nivel gravedad de la amiloidosis puede ser alto y provocar la insuficiencia de un órgano con consecuencia de muerte. Puede afectar a cualquier persona aunque los hombres la sufren con más frecuencia.
Patogenia
Un importante avance en la comprensión de la patogenia de la amiloidosis, ha sido el hallazgo de proteínas séricas precursoras. En principio, esto permitiría detener o reducir el depósito de amiloide en los tejidos bajando el nivel sanguíneo de la proteína precursora o eliminándola. Sin embargo, no se conoce exactamente el mecanismo por el cual se produce el depósito en los tejidos a partir de la proteína sérica. Se cree que se realiza por clivaje enzimático.
Por este mecanismo se ha logrado obtener in vitro fibrillas amiloídeas a partir de proteína de Bence-Jones, que corresponde a cadenas polipeptídicas livianas kappa o lambda. Pero no siempre se logra formar fibrillas. Además, in vivo en el mieloma, en que se excretan grandes cantidades de proteína de Bence-Jones por la orina, no se producen siempre depósitos de sustancia amiloídea. Lo mismo sucede en el amiloide AA: sólo bajo ciertas circunstancias se obtiene in vitro fibrilla amiloídea.
El precursor sérico del amiloide AA es un componente normal del suero humano que se comporta como una proteína reactiva en la fase aguda y que aumenta en las inflamaciones, infecciones, traumatismos, cirugía, tumores diseminados y otras condiciones patológicas. Pero la causa de la transformación in vivo de esta proteína en fibrilla amiloídea es desconocida.
Experimentalmente se ha podido comprobar que el suero humano tiene capacidad de degradar fibrillas AA; en cambio, el suero de pacientes con artritis reumatoide tiene esta capacidad muy reducida, como también el suero de algunos pacientes con inflamaciones crónicas.
En la actualidad se tiende a pensar que el depósito amiloídeo es un proceso dinámico en el que, por una parte, hay una constante neoformación de fibrillas amiloídeas a partir de precursores séricos, pero también existe una degradación constante de estas mismas fibrillas que llegan sólo a la amiloidosis cuando el segundo proceso es excedido por el primero.
Reconocimiento
Los órganos con amiloidosis presentan aumento de volumen a pesar de la atrofia parenquimatosa que produce la infiltración amiloidea; la consistencia está aumentada, es firme y elástica; la superficie de corte es vítrea. Si uno corta de un órgano macizo comprometido como el hígado, una lámina de un par de milímetros de espesor y la coloca sobre una hoja con un texto escrito, se puede leer éste a través del tejido.
El amiloide se reconoce sólo mediante métodos morfológicos. En tejidos frescos de autopsias, mediante la prueba del lugol. Se sumerge por unos minutos un corte delgado de tejido fresco, el tejido con infiltración amiloidea toma una color caoba. Si este corte de tejido se sumerge en una solución de ácido sulfúrico al 5%, el color vira a un tono verde-azulado con que se destaca mejor la zona comprometida. El reconocimiento histológico se hace mediante la tinción con Rojo de Congo, colorante que tiñe al amiloide de color pardo rojizo. El tejido así teñido debe ser examinado bajo luz polarizada, con la que el amiloide presenta característicamente un dicroismo verde.
Dicroismo es la propiedad de ciertos cristales birrefringentes de absorber en una determinada dirección, uno de los rayos polarizados, de manera que el cristal, en esa dirección, parece de otro color: si la luz incidente es blanca, en esa dirección aparece del color complementario al del rayo absorbido.
Si antes de realizar la tinción de Rojo de Congo el tejido es tratado con una solución de permanganato de potasio, un grupo de sustancias amiloídeas deja de teñirse con Rojo de Congo y de mostrar el dicroismo:es el amiloide sensible al permanganato de potasio, que corresponde generalmente a las forma AA (figura 2.9).
Las substancias amiloideas resistentes al permanganato de potasio corresponden, entre otros, a los amiloides AL, AS, endocrinos y familiares con neuropatía. El examen mediante el microscopio electrónico permite reconocer con seguridad pequeñas cantidades de sustancia amiloídea al demostrar las fibrillas típicas. El método inmunohistoquímico con el uso de anticuerpos específicos de cada tipo, está comenzando a usarse en la actualidad. Se distinguen dos formas de distribución: la generalizada y la localizada en un órgano.
Tipos de amiloidosis:
- Amiloidosis AL o amiloidosis primaria. Es la más frecuente y suele afectar el corazón, los riñones, el sistema nervioso y el hígado.
- Amiloidosis AA o amiloidosis secundaria. En este caso, la proteína se acumula mayoritariamente en los riñones, pero también puede extenderse a otras partes del cuerpo.
- Amiloidosis génetica. Es un tipo de enfermedad hereditaria.
- Amiloidosis relacionada con diálisis. Afecta a personas sometidas a diálisis a largo plazo. Las proteínas de la sangre se depositan en las articulaciones y tendones.
Factores de riesgo
Cualquier persona puede sufrir amiloidosis pero los principales factores de riesgo son:
- Ser hombre entre 60 y 70 años.
- Sufrir una enfermedad infecciosa o inflamatoria crónica.
- Antecedentes familiares.
- Seguir un tratamiento con diálisis.
Amiloidosis Localizada
Se producen en la piel, glándula tiroides, islotes de Langerhans, corazón, cerebro. El depósito de amiloide en los islotes de Langerhans aumenta con la edad, siendo muy frecuente por sobre los 70 años. Es más acentuado en diabéticos de tipo II (diabetes mellitus del adulto) de larga data, pero su relación exacta con esta enfermedad se desconoce.
El amiloide también se puede formar en tumores productores de algunas hormonas polipeptídicas como los insulinomas o nesidioblastomas funcionantes, el carcinoma medular del tiroides, en tumores secretores de hormona de crecimiento, etcétera.
Amiloidosis Generalizadas
En esta forma pueden distinguirse cinco grupos principales: 1. la primaria o idiopática, 2. la asociada a discrasia inmunocítica, 3. la secundaria o reactiva, 4. las heredofamiliares y 5. la senil.
La amiloidosis primaria o idiopática: es un trastorno en el cual las fibras de Proteínas se depositan en tejidos y órganos, causándoles daño. La causa de la amiloidosis primaria se desconoce, pero esta afección está relacionada con una producción anormal de anticuerpos por parte de un tipo de células inmunitarias llamadas células plasmáticas.
Los síntomas dependen de los órganos que se ven afectados por los depósitos, como la lengua, los intestinos, los músculos esqueléticos y lisos, los nervios, la piel, los ligamentos, el corazón, el hígado, el bazo y los riñones. La primaria o idiopática puede ser de tipo AL o AA, la asociada a discrasia inmunocítica es de tipo AL, la secundaria o reactiva es de tipo AA y las heredofamiliares de tipo AF salvo la asociada a fiebre mediterránea, que es de tipo AA. El tipo de la senil es AS.
Afecciones de la Amiloidosis Primaria
• Síndrome del túnel carpiano • Reflujo gastrointestinal (ERGE) • Daño al músculo cardíaco (miocardiopatía) • Insuficiencia renal • Malabsorsión
Los depósitos se acumulan en los órganos afectados, provocando que se vuelvan rígidos, lo cual disminuye su capacidad de funcionamiento. Aún no se han identificado los factores de riesgo. La amiloidosis primaria es poco común. Es similar al mieloma múltiple y se trata de la misma manera.
Síntomas
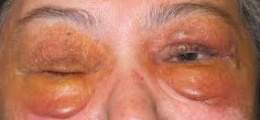
• Agrandamiento de la lengua • Fatiga • Ritmo cardíaco irregular • Entumecimiento de manos y pies • Dificultad respiratoria • Cambios en la piel • Dificultades para deglutir • Hinchazón de brazos y piernas • Debilidad para agarrar con la mano • Pérdida de peso.
Otros síntomas
• Heces color arcilla • Disminución del gasto urinario • Diarrea • Ronquera o cambios en la voz • Dolor articular • Otros problemas linguales • Debilidad.
Pruebas y exámenes
El Médico puede descubrir que usted presenta hepatomegalia o esplenomegalia. Si se sospecha el daño de un órgano específico, el médico puede ordenar exámenes para confirmar la amiloidosis en dicho órgano.
Por ejemplo: • Una ecografía abdominal puede mostrar hepatomegalia o esplenomegalia • Una biopsia de la almohadilla de grasa abdominal, una biopsia de la mucosa rectal o una biopsia de médula ósea pueden ayudar a confirmar el diagnóstico. • Una evaluación cardíaca, incluyendo ECG puede mostrar arritmias, sonidos cardíacos anormales o signos de insuficiencia cardíaca. Una ecocardiografía muestra un movimiento deficiente de la pared del corazón debido a la rigidez del músculo cardíaco (miocardiopatía) • Una evaluación para síndrome del túnel carpiano puede mostrar que el agarre de la mano es débil. La velocidad de conducción del nervio muestra anomalías. • Los exámenes de la función renal pueden mostrar signos de insuficiencia renal o demasiada proteína en la orina (síndrome nefrótico)o el nivel BUN se incrementa o la creatinina en suero es elevada o un análisis de orina muestra proteínas, cilindros o cuerpos grasos.
Esta enfermedad también puede alterar los resultados de los siguientes exámenes: • Proteína cuantitativa de Bence-Jones • Biopsia del túnel carpiano • Biopsia de la encía • Inmunoelectroforesis en suero • Biopsia del miocardio • Biopsia de nervio • Inmunoglobulinas cuantitativas • Biopsia de la lengua • Proteína en orina.
Tratamiento
Algunos de los pacientes afectados por amiloidosis primaria responden a la quimioterapia dirigida a las Células Plasmáticas Anormales. Se puede usar el trasplante de células madre, como en el mieloma múltiple.
En la amiloidosis secundaria, un tratamiento agresivo de la enfermedad subyacente puede mejorar los síntomas y/o disminuir la progresión de la misma. Complicaciones como la insuficiencia cardíaca, la insuficiencia renal y otros problemas algunas veces se pueden tratar en la medida de lo necesario.
Pronóstico)
La gravedad de esta enfermedad depende de los órganos que han sido afectados. El compromiso del corazón y de los riñones puede conducir a una insuficiencia de estos órganos y a la muerte. El compromiso sistémico está asociado con la muerte en un período de 1 a 3 años.
Posibles complicaciones:
• Insuficiencia cardíaca congestiva • Muerte • Insuficiencia endocrina (trastorno hormonal) • Insuficiencia renal • Insuficiencia respiratoria.
Cuándo contactar a un profesional médico
Consulte con el médico si aparecen síntomas acordes con el desarrollo de amiloidosis primaria. Si usted sabe que tiene amiloidosis primaria, llame al médico si se presenta dificultad respiratoria, hinchazón persistente de los tobillos u otras áreas, disminución en el gasto urinario u otros síntomas, lo cual puede indicar que se han producido complicaciones.
La distribución de la infiltración amiloidea en las formas primaria y asociada a discrasia inmunocítica es similar: vasos sanguíneos, miocardio, musculatura del tracto gastrointestinal, lengua, nervios y vasos renales. Así, clínicamente se presenta cardiomegalia, malabsorción intestinal, macroglosia, polineuropatía, insuficiencia renal crónica.
En la forma secundaria se afectan de regla: hígado, bazo, riñones (glomérulos, vasos, intersticio). Glándula suprarrenales, mucosa y vasos submucosos del tracto gastrointestinal.
Las amiloidosis heredofamiliares, si bien son generalizadas, se presentan con el compromiso preponderante de un órgano: riñones en la fiebre mediterránea familiar (enfermedad hereditaria autosómica recesiva), nervios, corazón y riñones respectivamente en otras tres amiloidosis hereditarias autosómicas dominantes. La amiloidosis senil es muy frecuente después de los 70 años. Se comprometen aorta, suprarrenales, vesículas seminales, articulaciones, lengua, islotes de Langerhans, hipófisis, encéfalo y corazón. El compromiso cardíaco puede llevar a la muerte.
En el bazo el depósito puede ocurrir predominantemente en la pulpa blanca o en la roja. Cuando se afecta la pulpa blanca, macroscópicamente destacan los folículos en forma de nodulillos blanquecinos y se denomina bazo de sagú. En cambio, cuando se afecta la pulpa roja, el depósito de amiloide es predominantemente en la pulpa roja, la superficie de corte del bazo muestra aspecto de jamón cocido y se lo llama bazo lardáceo.
Hasta mediados del Siglo XX las amiloidosis más frecuentes eran las secundarias a procesos inflamatorios crónicos (tuberculosis, lepra, linfogranuloma venéreo, supuraciones crónicas como bronquiectasias, abscesos, empiemas pleurales, osteomielitis crónica), a parasitosis y a ciertos tumores (cáncer del recto, pulmón, útero, esófago, riñón, linfoma de Hodgkin y otros linfomas). Estas amiloidosis hoy día son menos frecuentes principalmente debido al mejor tratamiento de los procesos inflamatorios, que ahora en menor proporción se hacen crónicos. La amiloidosis secundaria a la artritis reumatoide ha mantenido su frecuencia: alrededor del 10% de los casos.
Las amiloidosis de mayor frecuencia relativa en la actualidad son las AL asociadas a discrasia inmunocíticas, en que la cadena liviana de inmunoglobulina precursora es producida por células B como se observa en el 20% de los tumores derivados de estas células: los mielomas. Pertenecen a este grupo de discrasias inmunocíticas o plasmocelulares la macroglobulinemia de Waldenström, enfermedades de cadena pesada y otros tumores inmunocíticos.
Los depósitos amiloídeos pueden desaparecer cuando la causa que los produce es tratada. Esto puede suceder, por ejemplo, en tuberculosis, parasitosis y supuraciones crónicas tratadas y en tumores extirpados relacionados con amiloidosis generalizadas. La reabsorción es más rápida en el hígado y bazo, donde toma meses, en cambio, es más lenta en el glomérulo, donde demora años.
Del total de las amiloidosis generalizadas la asociada a discrasia inmunocítica representa en la actualidad más de la mitad de los casos, siguen en frecuencia las seniles, algunas localizadas, las del grupo AA y por último, las familiares.
Enlaces internos
Enlaces Externos
Fuentes
- Manual de Patología General.
- Buxbaum JN. The Amyloidoses. In: Goldman L, Ausiello D. Cecil Textbook of Medicine. 22nd ed. Philadelphia, Pa: WB Saunders; 2004.
- Hoffman R, Benz Jr. EJ, Shattil SJ, et al., eds. Hematology: Basic Principles and Practice. 4th ed. Philladelphia, Pa: Churchill Livingston; 2005:1540-48.