Diferencia entre revisiones de «Carbamida»
| Línea 2: | Línea 2: | ||
|Nombre=Carbamida | |Nombre=Carbamida | ||
|imagen=Carbamida1.png | |imagen=Carbamida1.png | ||
| − | |concepto=Compuesto químico constituido por [[carbono]], [[oxígeno]], [[nitrógeno]] e [[hidrógeno]]. Producto final del [[metabolismo de las proteínas]] y [[fertilizante]] de amplio uso en la agricultura.<br>}} <br>La urea o carbamida es un compuesto químico cristalino e incoloro. Su fórmula química es NH2 – CO – NH2. <br>También es conocida como carbonildiamida o ácido arbamídico. El nombre IUPAC es diaminocetona.<br>Es una sustancia nitrogenada producida por variados seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.<br>Posee propiedades higroscópicas y al disolverse en agua absorbe calor por lo que resulta fría y húmeda al tacto.<br>Es el fertilizante nitrogenado más valioso sin lastre, contiene hasta un 46 % de nitrógeno. También se utiliza como aditivo en la alimentación del ganado y sirve de materia prima para la industria de materiales plásticos, colas sintéticas, industria textil, y farmaceútica; de aquí que su producción industrial alcance varias decenas de millones de toneladas anuales.<br>La urea se forma en los tejidos animales como producto final del metabolismo de las proteínas, concentrándose en los riñones y siendo expulsada en la orina donde llega a representar el 80 % del nitrógeno disuelto.<br>==Propiedades físicas y químicas==<br>Fórmula global: CON2H4<br>Fórmula semidesarrollada: NH2 – CO – NH2<br>Masa molecular: 60.06 g mol-1<br>Estado de agregación: sólido.<br>Densidad: 1.34 g/cm³<br>Temperatura de fusión: 132.7 ºC<br>Calor de fusión: 24.18Jl/g<br>Calor de combustión: 10590 cal/g<br>Calor de disolución en agua: 241.8 J/g<br>Tiene un carácter ácido, siendo necesarios 84 partes de carbonato de calcio para neutralizar el efecto acidificante de 100 partes de urea.<br>Es altamente corrosiva al acero al carbono, poco corrosiva al aluminio, cinc y cobre y no a aceros especiales y el vidrio.<br>Es muy soluble en agua, alcohol y amoníaco.<br>==Estructura==<br>[[Image:Carbamida2.jpg]]<br>El carbono átomo central de la molécula de carbamida al cual se une un átomo de oxígeno mediante doble enlace y dos grupos aminos lo que confiere a la molécula una estructura plana.<br>==Obtención==<br>La carbamida se obtiene sintéticamente a partir del [[Amoníaco]] (NH3) y el [[Dióxido de carbono]] (CO2) cuya interacción comprende dos etapas. En la primera tiene lugar la formación de carbamato de amonio según la reacción:<br>2NH3 + CO2 = NH2COONH4 + 159.1 kJ<br>En la segunda etapa ocurren la deshidratación del carbamato formándose la carbamida:<br>NH2COONH4 = (NH2)2CO + H2O – 285kJ<br>Estas reacciones se verifican en los procesos industriales a temperaturas de 180 a 200 ºC y presión de 18∙106 - 2∙107 N/m2 ( 200 atmósferas)<br>==Aplicaciones==<br>Más del 90 % de la producción mundial de carbamida se destina a su uso como fertilizante, el cual se aplica tanto al terreno como a la superficie foliar de las plantas a través del riego.<br>La fácil solubilidad en el agua permite que sea absorbida por las raíces de las plantas.<br>Su utilización en la alimentación del ganado se fundamenta en que las bacterias de los estómagos de los mamíferos rumiantes son capaces de metabolizar la urea y aportar nitrógeno al organismo lo que redunda en un mayor rendimiento de proteínas.<br>A partir de la carbamida se obtienen resinas para producir materias plásticas valiosas como los llamados plásticos amínicos, losas de viruta de madera, colas sintéticas y compuestos para impregnar tejidos. También se emplea en la fabricación de fibras sintéticas conocidas como [[Urilón]].<br>La carbamida tiene una amplia aplicación en la industria farmacéutica estando presente en la composición química de medicamentos como la [[Carbamazepina]] y otros.<br>==Enlaces relacionados==<br>*[[Fertilizantes]]<br>*[[Proteínas]]<br>*[[Amoníaco]] | + | |concepto=Compuesto químico constituido por [[carbono]], [[oxígeno]], [[nitrógeno]] e [[hidrógeno]]. Producto final del [[metabolismo de las proteínas]] y [[fertilizante]] de amplio uso en la agricultura.<br>}} |
| + | <br>La urea o carbamida es un compuesto químico cristalino e incoloro. Su fórmula química es NH2 – CO – NH2. <br>También es conocida como carbonildiamida o ácido arbamídico. El nombre IUPAC es diaminocetona.<br>Es una sustancia nitrogenada producida por variados seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.<br>Posee propiedades higroscópicas y al disolverse en agua absorbe calor por lo que resulta fría y húmeda al tacto.<br>Es el fertilizante nitrogenado más valioso sin lastre, contiene hasta un 46 % de nitrógeno. También se utiliza como aditivo en la alimentación del ganado y sirve de materia prima para la industria de materiales plásticos, colas sintéticas, industria textil, y farmaceútica; de aquí que su producción industrial alcance varias decenas de millones de toneladas anuales.<br>La urea se forma en los tejidos animales como producto final del metabolismo de las proteínas, concentrándose en los riñones y siendo expulsada en la orina donde llega a representar el 80 % del nitrógeno disuelto.<br> | ||
| + | == Propiedades físicas y químicas == | ||
| + | <br>Fórmula global: CON2H4<br>Fórmula semidesarrollada: NH2 – CO – NH2<br>Masa molecular: 60.06 g mol-1<br>Estado de agregación: sólido.<br>Densidad: 1.34 g/cm³<br>Temperatura de fusión: 132.7 ºC<br>Calor de fusión: 24.18Jl/g<br>Calor de combustión: 10590 cal/g<br>Calor de disolución en agua: 241.8 J/g<br>Tiene un carácter ácido, siendo necesarios 84 partes de carbonato de calcio para neutralizar el efecto acidificante de 100 partes de urea.<br>Es altamente corrosiva al acero al carbono, poco corrosiva al aluminio, cinc y cobre y no a aceros especiales y el vidrio.<br>Es muy soluble en agua, alcohol y amoníaco.<br> | ||
| + | == Estructura == | ||
| + | <br>[[Image:Carbamida2.jpg]]<br>El carbono átomo central de la molécula de carbamida al cual se une un átomo de oxígeno mediante doble enlace y dos grupos aminos lo que confiere a la molécula una estructura plana.<br> | ||
| + | == Obtención == | ||
| + | <br>La carbamida se obtiene sintéticamente a partir del [[Amoníaco]] (NH3) y el [[Dióxido de carbono]] (CO2) cuya interacción comprende dos etapas. En la primera tiene lugar la formación de carbamato de amonio según la reacción:<br>2NH3 + CO2 = NH2COONH4 + 159.1 kJ<br>En la segunda etapa ocurren la deshidratación del carbamato formándose la carbamida:<br>NH2COONH4 = (NH2)2CO + H2O – 285kJ<br>Estas reacciones se verifican en los procesos industriales a temperaturas de 180 a 200 ºC y presión de 18∙106 - 2∙107 N/m2 ( 200 atmósferas)<br>==Aplicaciones==<br>Más del 90 % de la producción mundial de carbamida se destina a su uso como fertilizante, el cual se aplica tanto al terreno como a la superficie foliar de las plantas a través del riego.<br>La fácil solubilidad en el agua permite que sea absorbida por las raíces de las plantas.<br>Su utilización en la alimentación del ganado se fundamenta en que las bacterias de los estómagos de los mamíferos rumiantes son capaces de metabolizar la urea y aportar nitrógeno al organismo lo que redunda en un mayor rendimiento de proteínas.<br>A partir de la carbamida se obtienen resinas para producir materias plásticas valiosas como los llamados plásticos amínicos, losas de viruta de madera, colas sintéticas y compuestos para impregnar tejidos. También se emplea en la fabricación de fibras sintéticas conocidas como [[Urilón]].<br>La carbamida tiene una amplia aplicación en la industria farmacéutica estando presente en la composición química de medicamentos como la [[Carbamazepina]] y otros.<br> | ||
| + | == Enlaces relacionados == | ||
| + | <br>*[[Fertilizantes]]<br>*[[Proteínas]]<br>*[[Amoníaco]] | ||
| − | ==Referencias==<br>*Mujlionov, I. P. y otros. Tecnología Química General. Editorial Mir, Moscú, 1985.<br>==Fuentes==<br>*http://www.es.wikipedia.org/wiki/Urea<br>*http://www.textoscientificos.com/quimica/urea<br>*HTTP://WWW. laciudadatomica.blogspot.com<br> | + | == Referencias == |
| + | <br>*Mujlionov, I. P. y otros. Tecnología Química General. Editorial Mir, Moscú, 1985.<br> | ||
| + | ==Fuentes== | ||
| + | <br>*http://www.es.wikipedia.org/wiki/Urea<br>*http://www.textoscientificos.com/quimica/urea<br>*HTTP://WWW. laciudadatomica.blogspot.com<br> | ||
<br> | <br> | ||
Revisión del 21:16 31 mar 2011
| ||||||
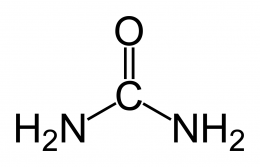
La urea o carbamida es un compuesto químico cristalino e incoloro. Su fórmula química es NH2 – CO – NH2.
También es conocida como carbonildiamida o ácido arbamídico. El nombre IUPAC es diaminocetona.
Es una sustancia nitrogenada producida por variados seres vivos como medio de eliminación del amoníaco, el cuál es altamente tóxico para ellos. En los animales se halla en la sangre, orina, bilis y sudor.
Posee propiedades higroscópicas y al disolverse en agua absorbe calor por lo que resulta fría y húmeda al tacto.
Es el fertilizante nitrogenado más valioso sin lastre, contiene hasta un 46 % de nitrógeno. También se utiliza como aditivo en la alimentación del ganado y sirve de materia prima para la industria de materiales plásticos, colas sintéticas, industria textil, y farmaceútica; de aquí que su producción industrial alcance varias decenas de millones de toneladas anuales.
La urea se forma en los tejidos animales como producto final del metabolismo de las proteínas, concentrándose en los riñones y siendo expulsada en la orina donde llega a representar el 80 % del nitrógeno disuelto.
Sumario
Propiedades físicas y químicas
Fórmula global: CON2H4
Fórmula semidesarrollada: NH2 – CO – NH2
Masa molecular: 60.06 g mol-1
Estado de agregación: sólido.
Densidad: 1.34 g/cm³
Temperatura de fusión: 132.7 ºC
Calor de fusión: 24.18Jl/g
Calor de combustión: 10590 cal/g
Calor de disolución en agua: 241.8 J/g
Tiene un carácter ácido, siendo necesarios 84 partes de carbonato de calcio para neutralizar el efecto acidificante de 100 partes de urea.
Es altamente corrosiva al acero al carbono, poco corrosiva al aluminio, cinc y cobre y no a aceros especiales y el vidrio.
Es muy soluble en agua, alcohol y amoníaco.
Estructura
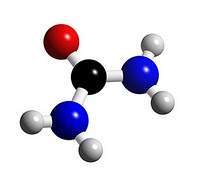
El carbono átomo central de la molécula de carbamida al cual se une un átomo de oxígeno mediante doble enlace y dos grupos aminos lo que confiere a la molécula una estructura plana.
Obtención
La carbamida se obtiene sintéticamente a partir del Amoníaco (NH3) y el Dióxido de carbono (CO2) cuya interacción comprende dos etapas. En la primera tiene lugar la formación de carbamato de amonio según la reacción:
2NH3 + CO2 = NH2COONH4 + 159.1 kJ
En la segunda etapa ocurren la deshidratación del carbamato formándose la carbamida:
NH2COONH4 = (NH2)2CO + H2O – 285kJ
Estas reacciones se verifican en los procesos industriales a temperaturas de 180 a 200 ºC y presión de 18∙106 - 2∙107 N/m2 ( 200 atmósferas)
==Aplicaciones==
Más del 90 % de la producción mundial de carbamida se destina a su uso como fertilizante, el cual se aplica tanto al terreno como a la superficie foliar de las plantas a través del riego.
La fácil solubilidad en el agua permite que sea absorbida por las raíces de las plantas.
Su utilización en la alimentación del ganado se fundamenta en que las bacterias de los estómagos de los mamíferos rumiantes son capaces de metabolizar la urea y aportar nitrógeno al organismo lo que redunda en un mayor rendimiento de proteínas.
A partir de la carbamida se obtienen resinas para producir materias plásticas valiosas como los llamados plásticos amínicos, losas de viruta de madera, colas sintéticas y compuestos para impregnar tejidos. También se emplea en la fabricación de fibras sintéticas conocidas como Urilón.
La carbamida tiene una amplia aplicación en la industria farmacéutica estando presente en la composición química de medicamentos como la Carbamazepina y otros.
Enlaces relacionados
*Fertilizantes
*Proteínas
*Amoníaco
Referencias
*Mujlionov, I. P. y otros. Tecnología Química General. Editorial Mir, Moscú, 1985.
Fuentes
*http://www.es.wikipedia.org/wiki/Urea
*http://www.textoscientificos.com/quimica/urea
*HTTP://WWW. laciudadatomica.blogspot.com