Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos
| ||||||||||||||||||||||
Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Autoridad Reguladora de Medicamentos de la República de Cuba encargada de promover y proteger la salud pública a través de sistema regulador capaz de garantizar el acceso oportuno al mercado de productos con calidad, seguridad, eficacia e información veraz para su uso racional. Desarrolla las funciones básicas de control de acceso a laboratorios, registro de medicamentos, diagnosticadores, equipos y dispositivos médicos, ensayos clínicos, vigilancia postcomercialización, inspecciones de buenas prácticas, liberación de lotes y otorgamiento de licencias a establecimientos.
Sumario
Misión
Garantizar la protección de la salud pública asegurando, mediante un sistema de regulación y control sanitario, que los medicamentos y diagnosticadores disponibles para el uso humano, ya sean importados o de fabricación nacional, tengan la seguridad, eficacia y calidad requeridas[1].
Visión
Consolidarse como una Autoridad Nacional Reguladora de Medicamentos y Diagnosticadores, reconocida por sus homólogos internacionales que trabaja para el cumplimiento de su misión con eficiencia y transparencia[2].
Historia
El Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED) es la Autoridad Reguladora de Medicamentos en Cuba (ARM) y se creó el 21 de abril de 1989, mediante la Resolución Ministerial No. 173 a partir del proyecto de desarrollo emprendido por la Dirección de Normalización, Metrología y Control de Calidad del Viceministerio Ciencia y Técnica del Ministerio de Salud Pública (MINSAP).
El objetivo perseguido con la fundación de esta institución fue centralizar las acciones de control sobre medicamentos y medios de diagnóstico “in vitro” (diagnosticadores) y desarrollarlas. Hasta ese momento, de las funciones de regulación y control que establece la Organización Mundial de la Salud (OMS) para los medicamentos, solamente existía el registro, y como actividad de postcomercialización, el control de las reacciones adversas de medicamentos en el Centro de Vigilancia Farmacológica, ubicados ambos en la Dirección de Farmacia y Óptica del Viceministerio de la Industria Farmacéutica.
A pesar de su importancia para un correcto diagnóstico del estado de salud humano, para los diagnosticadores solamente se disponía del aseguramiento de calidad de sus productores[3].
Como parte de los antecedentes del panorama de regulación que se transformó a partir de la creación del CECMED, las comprobaciones de laboratorio para los medicamentos en la cadena de distribución, sospechosos de alteraciones, reacciones adversas y aquellos para cuyos análisis los fabricantes no disponían de equipamiento o recursos, estaban a cargo de los Laboratorios Técnicos de Medicamentos de la propia industria, (LTM), donde se realizaban además labores de inspección para el control ambiental a los fabricantes.
Las inspecciones para verificar el cumplimiento de las disposiciones técnicas vigentes a la cadena de distribución mayorista, farmacias comunitarias y hospitalarias y las producciones locales, eran ejecutadas por la Dirección de Inspecciones del MINSAP, que incorporaba para las mismas a especialistas de la Dirección de Farmacia y Óptica, aunque no eran enfocadas al cumplimiento de buenas prácticas. Era necesaria una verdadera contrapartida para lograr el adecuado aseguramiento de calidad.
El CECMED como autoridad sanitaria, desde su etapa inicial garantizó la ausencia de conflicto de intereses al instaurarse como entidad reguladora independiente de la industria, aunque subordinada también al MINSAP, -situación resuelta totalmente en el 2001, en que la industria farmacéutica convencional pasó al Ministerio de la Industria Básica-. Su primera actividad fue la del Registro, el que se fortaleció al realizar evaluaciones integrales de las solicitudes en los campos de calidad farmacéutica, analítica, estudios preclínicos y clínicos.
Esto brindó un entorno técnico y organizativo adecuado, al reunirse en la institución actividades de evaluación que se complementan y retroalimentan entre sí, permitiendo el desarrollo e implementación de un sistema de evaluación con dictámenes parciales de calidad, seguridad y eficacia como exhaustivas evidencias documentadas para el respaldo de decisiones tomadas en estos procesos.
Una de las primeras medidas reguladoras fue la adopción del sistema nórdico de clasificación de medicamentos con base anatómica, terapéutica y química (ATC). Como resultado de este trabajo fueron editadas en 1991, las primeras normativas de la joven ARM, que fueron los Requisitos Generales para la Solicitud de Registro de Medicamentos en Cuba, para orientar el proceso de investigación y desarrollo de medicamentos nacionales. La segunda función desarrollada fue la de Inspecciones.
El CECMED estuvo al frente del equipo multidisciplinario que confeccionó las primeras Buenas Prácticas de Producción de Productos Farmacéuticos en 1992, publicadas como Norma Cubana y adoptadas mediante Resolución Conjunta del MINSAP y el Comité Estatal de Normalización.
Ya con estas dos funciones básicas en marcha se continuó con el diseño, equipamiento y desarrollo de los laboratorios de análisis físico-químicos y de microbiología, mientras paralelamente se fue fortaleciendo la actividad de control de diagnosticadores.
La Resolución que creó el CECMED declaró como su objetivo el de “Planificar, investigar, normar organizar, dirigir y controlar las actividades encaminadas a garantizar que todo medicamento y producto para el diagnóstico "in vitro" con destino a la investigación, la asistencia médica, el consumo de la población y la exportación cumpliera con los requerimientos establecidos en las regulaciones, normas y disposiciones vigentes en esta esfera declarados en la Política Farmacéutica Nacional Relacionada con el Control Estatal de la Calidad de Medicamentos y Diagnosticadores emitida en el año 2000.
Las funciones del CECMED fueron establecidas en 1994 y como sus roles se identificaron el perfeccionamiento de la base jurídica y metodológica del control, la actualización de requisitos y evaluación de solicitudes de registro, la autorización y control de ensayos clínicos, la fiscalización de las regulaciones vigentes, la inspección a la fabricación, licencias de producción, distribución, exportación e importación, la evaluación de calidad y liberación de lotes de productos biológicos, el control de los bancos de sangre como productores de materia prima farmacéutica, controles analíticos y de organización de materiales de referencia y la normación de calidad, seguridad y eficacia de productos de origen natural; brindando información científica y realizando la vigilancia postcomercialización.
A inicios de los 90 se acometió un acelerado proceso de formación de los recursos humanos y fomento de la regulación con patrocinio de la OMS/OPS. Entre 1992 y 1993 se realizaron 7 Talleres Nacionales con especialistas extranjeros invitados sobre los temas de Desarrollo del Sistema de Registro y Evaluación de Medicamentos, Aseguramiento de la Calidad de las Producciones Biológicas, Buenas Prácticas en la Fabricación y Control de Medicamentos, Homologación de Requisitos de Registro de Medicamentos de Uso Humano, Disolución, Biodisponibilidad y Bioequivalencia, Papel del CECMED en la Selección, Evaluación e Información de los Medicamentos, y Sistema de Evaluación y Registro de Diagnosticadores.
En el campo de los diagnosticadores en 1994 se otorgó una distinción por la Asociación Americana de Química Clínica a Cuba, por su trabajo con los laboratorios clínicos.
Desde 1981 se definieron los servicios de inscripción y renovación del registro de medicamentos extranjeros procedentes de área capitalista y se fijaron sus cuotas. En 1995 se modificaron y se inició el cobro de los nacionales y con el nuevo reglamento en el 2001 se actualizaron las tarifas equiparándolos con otras ARMs. Las bases desarrolladas para las Inspecciones de Buenas Prácticas comprenden el Reglamento para la Inspección Farmacéutica Estatal, diferentes ediciones de buenas prácticas para la fabricación y distribución de medicamentos y diagnosticadores y la revisión de proyectos de instalaciones a construir o remodelar con carácter de asesoría.
Cuba es un país productor de medicamentos biológicos y biotecnológicos, para este tipo de productos, debido a la variabilidad que los caracteriza cada lote puede considerarse como único, siendo éste el motivo por el cual, la Liberación de Lotes es de gran magnitud e importancia. Esta función fue iniciada a partir de 1993 y fortalecida con la incorporación de Cuba a la Red de Control de Calidad de Vacunas en 1994, en la actualidad son objeto de evaluación y liberación sobre bases definidas todos los lotes de vacunas nacionales o importadas y hemoderivados.
Los análisis físico-químicos se realizan desde 1993, aplicándose con regularidad desde 1995. El control microbiológico se estableció entre 1994 y 1996, funcionando regularmente desde el 2000. El Control Postcomercialización se desarrolla en conjunto con una red nacional en la que intervienen el Centro para el Desarrollo de la Farmacoepidemiología, su Unidad Coordinadora de Farmacovigilancia y el Programa Ampliado de Inmunización.
El desarrollo de un sistema de retirada de medicamentos defectuosos del mercado en toda la cadena de fabricación-distribución ha favorecido la efectividad de las medidas orientadas. La Evaluación de Ensayos clínicos se realiza partiendo de la obligación de tener autorizado por el CECMED los ensayos en humanos por Resolución del MINSAP desde 1991 teniendo en cuenta el movimiento y desarrollo de nuevos productos en el país y las magníficas condiciones de infraestructura sanitaria y hospitalaria de la que se dispone.
El CECMED ha sido una de las primeras autoridades del área latinoamericana en el empleo de la automatización para el registro de medicamentos con la instalación del sistema “CUBDIS” en 1989, derivado del utilizado en la ARM sueca. Con idénticos propósitos el “SIAMED” de la OMS fue instalado en 1993 y actualmente se fortalece su explotación, tanto para el registro como para las inspecciones. Actualmente se dispone de un Sistema Estadístico para el Control de los Trámites desarrollado en el país.
El proceso para la Armonización de Criterios de Evaluación y Registro Sanitario de Productos Farmacéuticos se inició en Agosto del 2001, en el marco de la Colaboración Bilateral Cuba-Venezuela y sus primeros acuerdos, relativos a la armonización de requerimientos y las facilidades para el registro, fueron firmados entre los dos gobiernos en el año 2004. También se han ejecutado intercambios con el Instituto de Vigilancia de Medicamentos y Alimentos de Colombia y con la Agencia Nacional de Vigilancia Sanitaria de Brasil. El CECMED colabora con proyectos de la OMS de precalificación de productos para combatir el SIDA, la Malaria y la Tuberculosis.
El 15 de julio de 2014 fue inaugurada la nueva sede del CECMED con la presencia del General de Ejército Raúl Castro Ruz, Primer Secretario del Comité Central del Partido y Presidente de los Consejos de Estado y de Ministros, la directora general de la Organización Mundial de la Salud (OMS), Margaret Chan, y de Carissa Etienne, directora general de la Organización Panamericana de la Salud (OPS)[4]. La nueva instalación es compartida con el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC), institución creada en 1991, con la misión de diseñar y conducir ensayos clínicos de productos médicos, farmacéuticos y biotecnológicos, así como cualquier otra tecnología sanitaria.
En 2011, en correspondencia con el Lineamiento 31 para la reducción de unidades presupuestadas el Centro para el Control Estatal de la Calidad de los Medicamentos se fusionó con el Centro de Control Estatal de Equipos Médicos, aunque mantuvo la denominación abreviada de CECMED, pero como Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos.
El centro cuenta con tecnología de punta para garantizar las buenas prácticas establecidas por la Organización Mundial de la Salud (OMS) y por la Organización Panamericana de la Salud (OPS). La novedosa y moderna instalación, fue concebida con materiales y sistemas tecnológicos de avanzada, que posibilitan la informatización de la gestión de las funciones del centro.
Objetivos
La Resolución que creó el CECMED declaró como su objetivo el de planificar, investigar, normar organizar, dirigir y controlar las actividades encaminadas a garantizar que todo medicamento y producto para el diagnóstico "in vitro" con destino a la investigación, la asistencia médica, el consumo de la población y la exportación cumpliera con los requerimientos establecidos en las regulaciones, normas y disposiciones vigentes en esta esfera declarados en la Política Farmacéutica Nacional Relacionada con el Control Estatal de la Calidad de Medicamentos y Diagnosticadores emitida en el año 2000.
Política y compromiso
Es compromiso del CECMED proteger la salud de nuestro pueblo cumpliendo sus funciones con rigor científico y ética profesional, garantizando la seguridad, eficacia y calidad de los medicamentos, mediante un servicio eficaz, transparente y oportuno sobre la base de la mejora continua y la implementación de un Sistema de Gestión de la Calidad con vistas a lograr la satisfacción de los clientes y otras partes interesadas.
Funciones
Las funciones fueron establecidas en 1994 y como sus roles se identificaron el perfeccionamiento de la base jurídica y metodológica del control, la actualización de requisitos y evaluación de solicitudes de registro, la autorización y control de ensayos clínicos, la fiscalización de las regulaciones vigentes, la inspección a la fabricación, licencias de producción, distribución, exportación e importación, la evaluación de calidad y liberación de lotes de productos biológicos, el control de los bancos de sangre como productores de materia prima farmacéutica, controles analíticos y de organización de materiales de referencia y la normación de calidad, seguridad y eficacia de productos de origen natural; brindando información científica y realizando la vigilancia postcomercialización.
Sistema de gestión de la Calidad
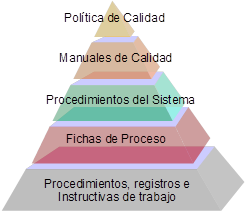
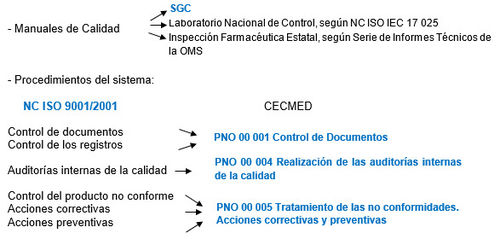
El CECMED, en la búsqueda de un sistema propicio para el mejoramiento del desempeño de sus funciones se propuso desde el año 2000 trabajar por la implementación de su Sistema de Gestión de la Calidad (SGC), responsabilidad que sería dirigida y coordinada por el Dpto. de Gestión de la Calidad, tomando como referencia las normas ISO 9000 lo que implica, la aplicación de un conjunto de requisitos organizativos y técnicos dirigidos fundamentalmente a garantizar la exigencia y cumplimiento de los estándares de un servicio altamente especializado que proporcione la agilización de los trámites correspondientes y la trazabilidad de sus procesos de modo que se logre sentar las bases para alcanzar una mayor credibilidad en sus decisiones, una mayor fortaleza y estabilidad de sus funciones y una sistematización en la planificación, el control y la mejora de la calidad de los procesos, así como a la elevación de los niveles de eficacia y eficiencia. Según los criterios de la OMS/OPS, los sistemas de Gestión de la Calidad constituyen un indicador a considerar para evaluar su calificación.El SGC, en la implementación del enfoque de procesos exigido por la norma, identifica sus procesos en correspondencia con las funciones establecidas para una ARM y cada uno de ellos es descrito en la fichas de proceso, documento donde se declaran: el representante del proceso y los criterios, métodos e indicadores necesarios para su medición y seguimiento así como su secuencia e interacción a través de diagramas de flujo.
Los procesos que integran el SGC actualmente son:
- De la alta dirección: -Planificación estratégica / -Gestión de los Recursos Humanos/ -Medición Análisis y Mejora.
- De Realización: -Recepción y entrega/ -Reglamentación/ -Registro/ -Inspección Estatal de Buenas Prácticas/ -Liberación de lotes/ -Autorización de ensayos Clínicos/ -Control analítico/ -Vigilancia postcomercialización
- De apoyo: -Aseguramiento Metrológico/ -Mantenimiento/ -Gestión de Recursos Materiales
Los procesos del SGC y su interacción son reflejados en el Mapa de procesos.
Los procesos en su desempeño se rigen por documentos elaborados y aprobados para el desarrollo de sus actividades y el mantenimiento de las evidencias objetivas. Estos documentos forman parte del sistema de documentación conjuntamente con los documentos obligatorios del SGC que son los siguientes:
.El sistema de control de documentos garantiza que los documentos, incluyendo los registros, relacionados con la calidad sean identificados, elaborados, revisados, aprobados, registrados, archivados, distribuidos y actualizados de manera sistemática, eliminándose de los puestos de trabajo las ediciones no vigentes.
La documentación externa formada fundamentalmente por las regulaciones farmacéuticas y normas nacionales e internacionales, farmacopeas y las guías de referencia que son aplicables al control de medicamentos forma parte de la documentación del SGC y se mantiene identificada y actualizada.
El control de los documentos garantiza la disponibilidad de la documentación vigente para todo el personal de la Institución.
El Sistema de Gestión de la Calidad, realiza, de acuerdo a lo que establece la norma la medición sistemática de los procesos, las especificaciones del servicio y la percepción del cliente
En el 2007, se solicita el inicio del proceso de certificación a la Oficina Nacional de Certificación de Cuba (ONN) y a la Asociación de Normalización y Certificación de España (AENOR) y en el 2008 es otorgada la certificación al Sistema de gestión de la Calidad del CECMED, la cual que se mantiene vigente según se expresa en el esquema donde se refleja el proceso de certificación.
Los resultados obtenidos en todas las actividades relacionadas con el Sistema de Gestión de la Calidad son publicados en la Intranet del Centro a través del Sitio Web de Calidad, lo cual permite, a todos los especialistas del CECMED la disponibilidad de información oportuna y actualizada con relación a la calidad de nuestro desempeño.
La implementación del sistema de gestión de la calidad ha permitido solucionar las deficiencias identificadas y contribuir de manera significativa a la elevación de la cultura de la calidad, lo que ha implicado un nivel de organización superior y una mayor comprensión del protagonismo de cada uno de los implicados en el logro de los objetivos deseados.
El SGC transcurrirá por dos momentos: el actual, basado en la organización de los procesos, el enfoque al cliente y la mejora continua, y posteriormente, en futuras revisiones, deberá incluir el enfoque basado en los riesgos como fase superior en el control estatal de la calidad de los medicamentos, tendencia que ya se está desarrollando en agencias nacionales del primer mundo.
El sistema de gestión de la calidad favorece el mejor desempeño de la ARM de Cuba hacia el incremento en la satisfacción de sus clientes y al ahorro de recursos necesarios, todo lo cual apunta hacia una mayor confiabilidad en los medicamentos disponibles en el mercado, De ello dan fe, el reconocimiento obtenido de la OMS/OPS como autoridad de referencia de la región y la certificación ISO 9001 otorgada en el 2008 al Sistema de Gestión de la Calidad implementado, según las normas vigentes, por los órganos certificadores: Oficina Nacional de Normalización (ONN) y la Agencia Española de Normalización (AENOR)), certificación que ha sido mantenida hasta el 2014. Estos avales son evidencias de un compromiso y actuación adecuados en el control de medicamentos y la protección de la población.
Publicaciones
Referencias
- ↑ Misión del centro. Disponible en:Sitio oficial del CECMED. Consultado el 16 de julio de 2014
- ↑ isión del centro. Disponible en:Sitio oficial del CECMED. Consultado el 16 de julio de 2014
- ↑ Historia del centro. Disponible en:Sitio oficial del CECMED. Conssultado el 16 de julio de 2014
- ↑ Preside Raúl inauguración de nuevas sedes de instituciones científicas cubanas. Disponible en:Diario Granma. Consultado el 16 de julio de 2014
Fuentes
- CECMED. Visitado el 5 de octubre de 2015.
- Misión. Visitado el 5 de octubre de 2015.
- Visión. Visitado el 5 de octubre de 2015.
- Historia. Visitado el 5 de octubre de 2015.
- Sistema de gestión de la calidad. Visitado el 5 de octubre de 2015.
- Política y compromiso. Visitado el 5 de octubre de 2015.