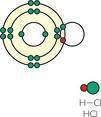
Cloruro de Hidrógeno
Cloruro de Hidrógeno. Gas ligeremante amarillo con un amplio campo de acción. Su temperatura de fusión es de - 112 grados celsius y con una densidad de 1,19 gramos por centímetros cúbicos y un calor de formación de 22,06 kilocaloría por mol.
Sumario
Obtención
El Cloruro de Hidrógeno puede prepararse de diversos modos. Los dos métodos más importantes y más usados son:
1. Por combinación directa de hidrógeno y cloro
2. Por la acción del ácido sulfúrico.
Combinación directa de hidrógeno y cloro
Cada vez es mayor la cantidad de ácido clorhídrico que se prepara combinando directamente hidrógeno y cloro obteniendo como subproductos en la fabricación de hidróxido de sodio por electrólisis de una disolución de cloruro sódico. El cloro se quema en exceso de hidrógeno, o de gas natural, en mecheros especiales.
Por la acción del ácido sulfúrico
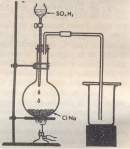
El método usualmente empleado en el laboratorio para preparar Cloruro de Hidrógeno se basa en la reacción: ClNa + SO4H2 = SO4HNa + ClH
Se hace caer el ácido lentamente, gota agota, sobre la sal, de un embudo de llave, mientras el matraz se calienta poco a poco. El Cloruro de Hidrógeno se desprende y puede recogerse por desplazamiento ascendente del aire, o puede disolverse en agua. Como el Cloruro de Hidrógeno es insoluble en ácido sulfúrico concentrado y se separa de la mezcla reaccionante, la reacción no puede invertirse, y se hace prácticamente completa. Pero si se disuelve el gas en una disolución saturada de bisulfato sódico, se obtiene un precipitado de CLNa, pues la sal común es muy poco soluble en ácido clorhídrico concentrado.
El Cloruro de Hidrógeno se fabrica industrialmente tratando cloruro sódico con ácido sulfúrico concentrado en grandes retortas de hierro colado. La reacción trascurre en dos etapas; la primera se desarrolla a temperatura ligeramente baja , y produce ClH y SO4HNa (bisulfato sódico). Una vez terminada la primera fase, la mezcla de SO4HNa y ClNa se lleva a otra retorta, donde se calienta al rojo, produciéndose la segunda reacción:
ClNa + SO4HNa = SO4Na2 + ClH
Así se obtiene más cloruro de hidrógeno, y queda como residuo sulfato sódico. El gas desprendido se disuelve en una batería de receptores para preparar ácido clorhídrico comercial, con una densidad de 1,196 g por centímetros cúbicos y 38,9 % del compuesto.
Propiedades
Propiedades Físicas
El Cloruro de hidrógeno es un gas incoloro, de olor fuerte e irritante y de sabor agrio. Puede licuarse a 10 oC, sometiéndolo a una presión de 40 atmósferas. El líquido hierve a – 83,7 oC a la presión ordinaria. El gas es muy estable a 1500 oC, menos del 0,3 % esta disociado en sus elementos.
En estado gaseoso humea en el aire húmedo, por formar una niebla de goticas de ácido clorhídrico. Con el agua forma una mezcla azeótropa o de punto de ebullición constante, con 20,2 % de ClH, la cual hierve a 108,6 oC a la presión de una atmósfera.
Existe una relación sencilla entre la densidad de una disolución de ácido clorhídrico y su contenido en ClH. Aproximadamente, el doble de la parte decimal de la densidad es el tanto por ciento en peso de ClH. Así por ejemplo, un ácido de densidad 1,15 es, prácticamente, de un 30 % en peso de ClH.
Propiedades Químicas
El HCl anhidro líquido no conduce la corriente eléctrica. No reacciona con el zinc, pero basta añadir una pequeña cantidad de agua para iniciar la reacción, desprendiéndose hidrógeno . Cuando se calienta cloruro de hidrógeno con los metales más activos, hay reacción, produciéndose los cloruros de los metales e hidrógeno. Este método de preparar cloruros es el que se emplea cuando no pueden obtenerse anhidros a partir de una disolución acuosa. Así el cloruro ferroso anhidro, FeCl2 y el cloruro de aluminio anhidro, AlCl3, pueden obtenerse calentando el metal en una corriente de cloruro de hidrógeno.
El cloruro de hidrógeno se combina directamente con amoníaco para formar una nube blanca de cloruro amónico (partículas sólidas): HCL + NH3 = NH4CL
La actividad del ácido clorhídrico en disolución se debe a la presencia del ion hidronio, el cual se forma cuando el cloruro de hidrógeno covalente reacciona con el agua. El ácido clorhídrico reacciona enérgicamente con los metales activos para dar los cloruros respectivos e hidrógeno, y con óxidos e hidróxidos para formar los cloruros y agua.
En general, los cloruros de los metales son solubles en agua, excepto los de plata, AgCl, plomo, PbCl2, mercurioso, Hg2Cl2, cuproso, CuCl y talioso, TaCl
Identificación de riesgos
Incendio Sustancia no combustible
Explosión Cuando el cloruro de hidrógeno en solución acuosa (ácido clorhídrico) entra en contacto con metales produce hidrógeno que puede formar mezcla explosiva con el aire.
Exposición Inhalación: La mayoría de las exposiciones ocurren por inhalación. El olor del cloruro de hidrógeno y las propiedades irritantes para el tracto respiratorio superior proporcionan una alarma adecuada de concentraciones peligrosas. El cloruro de hidrógeno es más pesado que el aire y puede causar asfixia en recintos situados por debajo del nivel del suelo, poco ventilados, o cerrados. Es una sustancia corrosiva que cuando se inhala puede provocar sensación de quemazón, tos, dificultad respiratoria, jadeo y dolor de garganta (Síntomas no inmediatos).
Ingestión: La ingestión de cloruro de hidrógeno es improbable porque es gaseoso a temperatura ambiente. Soluciones acuosas (ácido clorhídrico) causan lesiones corrosivas graves si se ingieren.
Contacto con la piel: El contacto directo con cloruro de hidrógeno líquido o gas concentrado sobre la piel húmeda o mojada causa graves quemaduras químicas. No se absorbe bien por la piel.
Contacto con los ojos: El cloruro de hidrogeno es una sustancia corrosiva que cuando entra en contacto con los ojos puede provocar dolor, visión borrosa y quemaduras profundas graves.
Aplicación
El ácido clorhídrico sigue inmediatamente al sulfúrico en importancia industrial. Se emplea como catalizador para obtener glucosa y otros productos por hidrólisis del almidón, en la industria textil, de colorantes y drogas, para preparar cloruros de diversos metales, y baño de decapado, para eliminar la escoria de óxido de las chapas de hierro antes de estañar, galvanizar o esmaltar. Los fabricantes de cola se sirven de él para extraer el producto de los tejidos animales (pieles, pezuñas y cartílagos.)
De manera general es usado para limpiar, decapar, y electrogalvanizado de metales; en refinado de menas de mineral; curtido de pieles; y refinado de grasas, jabones y aceites comestibles. Es usado también en la producción de polímeros y plásticos, goma, fertilizantes, tintes, materiales colorantes, y pigmentos.
Fuentes
- Bonner WA, Castro AJ. Química Orgánica Básica. 2 ed. La Habana; Editorial Pueblo y Revolución. 1979
- http://www.murciasalud.es/recursos/ficheros/99965-Clorurodehidrogeno.pdf
- Babor JA. Química General Moderna. 1ra reimpresión, Editorial Pueblo y Educación. 1978
- Durán Rivas Yunior, Ing Químico. Apuntes de Química. Santiago de Cuba, Cuba, 2000