Energía de Gibbs
| ||||||
Energía de Gibbs. Es un potencial termodinámico que tiene unidades de energia que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes).
Características
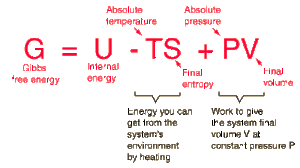
En la termodinámica química de las reacciones y en los procesos no cíclicos, existen cuatro cantidades útiles llamadas "potenciales termodinámicos". Estos son la energía interna, la entalpía, la energía libre de Helmholtz y la energía libre de Gibbs. La energía libre de Gibbs se define por
Estudios
La energía interna U, podría ser considerada como la energía necesaria para crear el sistema, en ausencia de cambios en la temperatura o el volumen.
Pero tal como se estudió en la definición de entalpía, se debe realizar una cantidad adicional de trabajo PV, si se crea el sistema desde un volumen muy pequeño, con objeto de "crear espacio" para el sistema. Tal como se estudió en la definición de energía libre de Helmholtz, el medio ambiente a una temperatura constante T, contribuirá al sistema con una cantidad TS, reduciendo de esta manera la inversión total necesaria para la creación del sistema. Esta contribución neta de energía al sistema, creado a temperatura ambiente T desde un volumen inicial despreciable, es la energía libre de Gibbs.
En una reacción, el cambio en la energía libre de Gibbs ΔG, es un parámetro muy útil. Se puede considerar que es la máxima cantidad de trabajo que se puede obtener de una reacción. Por ejemplo, en la oxidación de la glucosa, el cambio en la energía libre de Gibbs es ΔG = 686 kcal = 2870 kJ. Esta es la reacción principal de energía en las células vivas.