Enfermedad hemolítica del recien nacido
| ||||||
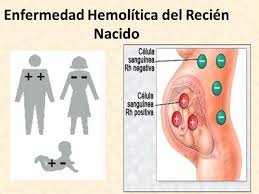
Enfermedad hemolítica del recién nacido. La eritroblastosis fetal (EF) o enfermedad hemolítica del recién nacido (EHRN) es una alteración en la que ocurre una destrucción de eritrocitos fetales o del neonato mediada por anticuerpos maternos que cruzan la barrera placentaria y que se produjeron en respuesta al paso de eritrocitos fetales incompatibles con los de la madre a través de la circulación
placentaria.
Introducción
La incompatibilidad madre-hijo puede abarcar diferentes sistemas de antígenos eritrocitarios; la más común es la relacionada con el sistema ABO, pero la mayor parte de las veces tiene poca importancia clínica. Otros antígenos menores, como el Kell, [[]]Duff y o MNS, explican un muy pequeño porcentaje de EHRN.
Es definitivamente la incompatibilidad por el sistema Rh compuesto por más de 50 antígenos la que representa el mayor problema, pues, no obstante ser menos común que la ABO, la gravedad del proceso hemolítico puede llegar a ser muy seria; sin embargo, se presentan también casos autolimitados o de moderada intensidad donde no se requieren medidas terapéuticas especializadas.
La tendencia en los países desarrollados es a observar cada vez con menor frecuencia casos de EHRN por incompatiblidad Rh en vista del uso generalizado de la inmunoglobulina antiRh en nuestro país; sin embargo, aunque con menor frecuencia, todavía es la causa más frecuente de hemólisis grave en el periodo neonatal.
Fisiopatología
Desde la demostración original de la existencia del factor Rh se han podido confirmar más de 50 antígenos que con-forman este sistema; sin embargo, más del 90% de los casos de EHRN por isoinmunización Rh se debe al antígeno D. Se definen como Rh positivos aquellas personas que pre-sentan este antígeno, sea en forma heterocigota (D/d) o en forma homocigota (D/D); los individuos Rh negativos, por su parte, no heredaron este antígeno, por lo que su ausencia se denomina por conveniencia D negativo, aunque no hay antígeno D alguno.
Prácticamente el 100% de los embarazos cursa con diversos grados de transfusión fetomaterna, es decir, el paso de eritrocitos fetales a la circulación materna; sin embargo, en una buena parte de los casos la cantidad de sangre no es lo suficiente importante para que haya una sensibilización; ésta requiere de al menos el paso de 1 ml de sangre fetal incompatible y tal situación ocurre sobre todo durante el parto, en abortos o durante el procedimiento de amniocentesis. Se ha podido definir que la sensibilización de madres Rh negativas con productos Rh positivos ocurre en menos del 10% de los embarazos; el riesgo de que suceda se incrementa en relación directa con el número de embarazos.
Para que se presente la EHRN mediada por los anticuerpos IgG correspondientes a la respuesta inmune secundaria y capaz de cruzar la placenta, es necesario que previamente haya una sensibilización de la madre al antígeno paterno presente en los eritrocitos del producto y que ella no posee. Esta sensibilización puede presentarse por dos diferentes mecanismos: la administración por error de sangre Rh positiva a una mujer Rh negativa, y el paso de glóbulos Rh positivos fetales a la circulación materna en un embarazo previo. Este último mecanismo a su vez se explica por diferentes razones, todas ellas con un principio común bien aceptado: “el sangrado fetomaterno”, que suceden como se mencionó en casi todos los embarazos (60%) y son aún más importantes en cesáreas, extracciones manuales de la placenta, amniocentesis y aborto espontáneo o inducido.
Cuando la madre Rh negativa es expuesta por primera vez a los eritrocitos D positivos, se presenta de manera inicial una respuesta inmune primaria, con producción de anticuer-pos de clase IgM, que por su tamaño no cruzan barrera placentaria y por tanto no tienen trascendencia clínica. Si ocurre el estímulo inmune secundario representado por un segundo embarazo con un feto Rh D positivo, se produce la respuesta secundaria, con un incremento en anticuerpos antiD de tipo IgG que sí cruzan la barrera placentaria y conducen a la destrucción de los eritrocitos, ediada por la acción de los macrófagos esplénicos y otras células efectoras citotóxicas. De las diferentes subclases de IgG se ha podido determinar que la IgG1 cruza más temprano la barrera placentaria, pro-duciendo una anemia más intensa no obstante ser, cuando menos in vitro,menos hemolítica que la IgG3.
Los casos de EHRN por incompatibilidad en el sistema ABO tienen algunas características diferentes a los que suceden por incompatibilidad Rh o por otros grupos. Aquí no es necesaria una sensibilización previa, es decir, puede manifestarse desde el primer embarazo, no hay manera de evitarla como en los casos de incompatibilidad Rh, la mayor parte de las veces se observa en una madre de grupo O con productos de tipo A o B y como ya se dijo por lo general son autolimitados y por tanto tienen poca importancia clínica no obstante ser las más frecuentes.
Cuadro clínico
El cuadro clínico puede variar desde una anemia leve hasta un cuadro grave con mortalidad alta; esta variación depende básicamente de dos circunstancias: el grado de destrucción de los eritrocitos fetales y el grado de compensación en la producción de glóbulos rojos por el feto. A su vez, el cuadro clínico gira alrededor de la anemia y de la hiperbilirrubinemia (HBB).
Cuando no es posible compensar la hemólisis de manera adecuada, el feto presenta anemia, que en casos graves da origen a insuficiencia cardiaca congestiva, acompañada de hepatoesplenomegalia masiva secundaria a la hematopoyesis extramedular que causa compresión y disfunción de los hepatocitos, lo que culmina en hipoalbuminemia grave, ascitis, derrame pleural y por último edema generalizado o anasarca. Lo anterior se conoce como hidropesía fetal y por lo general termina con la vida del producto en el útero o en las primeras horas de vida; por fortuna, este curso se manifiesta en menos del 20% de los casos.
Casi todos los recién nacidos con EHRN por Rh nacen con anemia leve que no requiere de transfusiones, o moderada en donde si es bien compensada se presenta sólo hepatoesplenomegalia moderada y secundaria a la eritropoyesis extramedular. Debido a que la placenta tiene una gran capacidad “aclaradora” del exceso de bilirrubina, la mayoría de los niños no presenta ictericia al nacer; por lo general, ésta ocurre durante las primeras 12 a 24 h de vida y tiene su punto máximo en los primeros tres o cuatro días; una vez nacidos, a la importante concentración de bilirrubina indirecta producto de la destrucción de los eritrocitos se agrega el problema que significa la inmadurez hepática fisiológica de los recién nacidos que no permite el paso de bilirrubina indirecta a directa con la rapidez suficiente, de suerte que al rebasarse la capacidad de la albúmina para unirse a la bilirrubina indirecta ésta empieza a depositarse en los tejidos.
Cuando sucede en el sistema nervioso central, sobre todo en los ganglios basales y en el cerebelo, se le conoce como kernicterus dando lugar a manifestaciones neurológicas graves; sólo un pequeño porcentaje de pacientes con esta complicación fallece; los sobrevivientes por lo regular tendrán secuelas graves, que incluyen parálisis cerebral infantil, sordera, etc. En la actualidad, gracias a las medidas profilácticas y al tratamiento temprano y eficaz, este tipo de complicaciones se observa con muy poca frecuencia.
Diagnóstico
El diagnóstico de la EHRN por Rh se puede establecer antes o después del nacimiento del neonato en quien se sospecha la enfermedad. En el diagnóstico prenatal debe iniciarse con una historia clínica completa donde se detallen factores obs-tétricos, como abortos previos, hermanos afectados y antecedente de transfusiones y cuantificación de grupos sanguíneos en ambos padres.
En las embarazadas es importante definir, mediante una prueba de Coombs indirecta, para demostrar la presencia de un anticuerpo libre en el suero materno a partir de la semana número 16 de la gestación, y en caso de resultar positiva debe identifi carse el anticuerpo participante y el título del mismo, el cual ha de monitorearse durante el resto del embarazo casi cada dos semanas. Se acepta que en la forma más común mediada por el antígeno D, títulos inferiores a 1:16 por lo general no dan lugar a procesos hemolíticos graves.
Cuando se hallan títulos superiores es necesario llevar a cabo un monitoreo estricto del embarazo para definir la gravedad del proceso hemolítico, y esta valoración incluye la realización de una ecografía para conocer la función cardiaca, el volumen de líquido amniótico y la velocidad de flujo sanguíneo en la arteria cerebral media, la cual será alta en mayor o menor grado en relación con la gravedad de la anemia; además, en algunos casos será necesario analizar el líquido amniótico por medio de una amniocentesis para, mediante es-pectrofotometría, determinar el contenido de bilirrubina en el mismo y establecer de esta forma la gravedad de la hemólisis.
Una vez nacido, la valoración clínica y los estudios de laboratorio permiten confi rmar inicialmente la sospecha diagnóstica y definir la gravedad del problema. La valoración clínica debe incluir la exploración física para corroborar la presencia de hepatoesplenomegalia, derrame pleural, índice de función cardiaca, dificultad respiratoria, presencia de ictericia y manifestaciones neurológicas. La concentración de hemoglobina, el porcentaje de reticulocitos y la presencia de eritroblastos en sangre periférica dependerán de la gravedad de cada caso en particular. Resulta claro que dichos valores deben vigilarse estrechamente en el periodo neonatal inmediato, ya que pueden ser normales en el posparto inmediato.
La prueba directa de la antiglobulina humana (prueba de Coombs directa) debe efectuarse en los eritrocitos del neonato para demostrar la presencia de anticuerpos unidos a la membrana del eritrocito y la cual resulta positiva prácticamente en todos los casos. Por otra parte, es común cierto grado de leucocitosis y con alguna frecuencia ocurre trombocitopenia atribuida a una coagulación intravascular diseminada. Por último, tomando en cuenta que el depósito de la bilirrubina indirecta en el sistema nervioso central es la principal complicación y una amenaza para la vida, el monitoreo estricto de la bilirrubina es de gran importancia para el seguimiento de los casos; además, deben conocerse las concentraciones de albúmina y gasometrías venosas.
Tratamiento
Se comentan por separado tanto la prevención de la aloinmunización como el tratamiento prenatal y el del neonato enfermo propiamente dicho en el entendido que todos estos aspectos están relacionados de manera muy importante. En la actualidad, con el uso generalizado de la administración de inmunoglobulina anti-Rh (IgG anti-D), que inició su aplicación en el decenio de 1970, se ha reducido de manera significativa la prevalencia de la EHRN por incompatibilidad Rh.
Se acepta que las mujeres Rh negativas deben recibir la inmunoglobulina en las semanas 28 y 34 de gestación; tam-bién han de recibirla las mujeres Rh negativas que tengan un neonato Rh positivo y que no estén isoinmunizadas (prueba de Coombs indirecta negativa). La aplicación será antes de las 72 h después del nacimiento; la dosis recomendada es de 300 μg; cuando se ha sufrido un aborto espontáneo o inducido durante el primer trimestre del embarazo se recomienda la aplicación de al menos 50 μg.
La dosis de IgG anti-D eficaz para evitar la sensibilización al antígeno D es de 20 μg por cada mililitro de eritrocitos D positivos, por lo que la dosis estándar de 300 μg protege contra una hemorragia transplacentaria (HTP) de 15 ml de glóbulos rojos, o sea, el equivalente a 30 ml de sangre total. El 4% de las mujeres tiene una HTP > 30 ml, lo que ocasiona el mismo porcentaje de fracasos en la protección conferida por la administración pasiva del anticuerpo IgG anti-D. Existe un preparado de IgG anti-D para uso intravenoso que es igualmente eficaz, pero que se utiliza con más frecuencia para el tratamiento inicial de la púrpura trombocitopénica inmune.
Es obvio que la IgG anti-D carece de utilidad una vez que la madre ya ha iniciado la producción del anticuerpo, mismo que se detecta en el suero materno por medio de la prueba de Coombs indirecta; tampoco se debe administrar este producto a las mujeres cuyo producto es Rh D negativo.
Por otro lado, se ha recomendado plasmaféresis, administración intravenosa de inmunoglobulina, o ambas cosas, con el propósito de tratar de suprimir la aloinmunización en la embarazada; sin embargo, se tiene el inconveniente del alto costo económico que esto representa; el efecto rebote que se observa con frecuencia y el riesgo que implica el procedi-miento de la plasmaféresis, parecería volver de cualquier modo razonable considerar estas opciones en casos especiales.
El tratamiento prenatal de la EHRN por Rh, también llamado tratamiento fetal, está basado en la transfusión sanguínea intrauterina (TSI), la cual puede administrarse por vía intraperitoneal o por vía intravascular de uso más mo-derno; dicho procedimiento propio de instituciones especia-lizadas tiene como fi n permitir que el feto llegue a una edad gestacional donde el nacimiento pueda ocurrir con menos riesgo para él sin las graves complicaciones de la hidropesía.
Por lo general, se recomienda cuando el hematócrito fetal es menor de 30%; debe llevarse a cabo con sangre ABO com-patible y sin el antígeno problema presente, con menos de 72 h de haber sido extraída, libre de leucocitos, negativa para citomegalovirus, compatible con el suero materno; además, debe ser radiada previamente para evitar el riesgo de que el feto desarrolle una grave complicación, casi siempre mortal, la enfermedad de injerto contra el hospedador relacionada con transfusión. Parece haber ventaja con la transfusión intravascular y hay fórmulas para la obtención de la cantidad de sangre a transfundir y los periodos en que deben llevarse a cabo.
Por último, con respecto al tratamiento del neonato afectado por la EHRN, éste se enfoca al control de la anemia y la HBB con la utilización de la fototerapia (FT) y la exangui-notransfusión (EST).
El tratamiento de la anemia varía según la gravedad de cada caso; algunas ocasiones se requiere de la corrección intensiva del volumen sanguíneo y en otras sólo la transfusión ordinaria de concentrado globular.
Con respecto a la HBB, la fototerapia juega un papel muy importante; su principal objetivo es disminuir la concentra-ción de bilirrubina para evitar hasta donde sea posible la rea-lización de la EST y es a través de la fotoisomerización y la fotooxidación que un porcentaje de bilirrubina indirecta causante del daño nocivo, en especial para el sistema nervioso central como ya se comentó, se transforme en fotoisómeros no tóxicos (fotobilirrubina y luminorrubina) que se transportan, metabolizan y eliminan más rápido.
Otra medida de más reciente introducción en el trata-miento de estos enfermos es la administración de inmu-noglobulina intravenosa (IGIV ), generalmente a una dosis única de 1 g/kg de peso del paciente; tiene como objetivo principal el hecho probado de disminuir las posibilidades de que el paciente requiera de una EST; su mecanismo de acción parece estar relacionado con el bloqueo de los receptores de anticuerpos en los eritrocitos. Conviene conocer los principios generales acerca del pro-cedimiento de la EST en el tratamiento de los neonatos gra-vemente enfermos en los que la FT no basta para disminuir la concentración de bilirrubina sérica.
El propósito de este procedimiento incluye la corrección de la anemia, la elimi-nación de eritrocitos fetales unidos ya al anticuerpo que son una fuente potencial de bilirrubina, la eliminación de anti-cuerpos libres y la eliminación de la bilirrubina propiamente dicha. En general, se intenta llevar a cabo un recambio del doble del volumen sanguíneo del neonato, es decir, se calcula sobre 160 y 200 ml/kg de peso según la edad gestacional del pa-ciente, correspondiendo la primer cifra a un neonato a término y la segunda a uno prematuro; de esta forma, el objetivo es eliminar cerca del 90% de los eritrocitos afectados y reducir hasta en un 35% la concentración de bilirrubina indirecta.
La indicación de la EST es según tablas de referencia que nos permiten definir el momento más adecuado para llevar a cabo el procedimiento; estas tablas dependen básicamente de la concentración sérica de bilirrubina, de la edad gestacional del neonato y de las horas o días de vida extrauterina.
La sangre tiene que ser reciente; preferentemente debe tener menos de 72 h de haber sido extraída para asegurar un contenido de glóbulos rojos adecuado de 2 a 3 DPG y evitar el riesgo de hiperpotasiemia o de acidosis relacionada con la sangre que tiene más días de haber sido extraída; debe ser negativa para citomegalovirus y además debe utilizarse un sistema para lograr que la sangre tenga una temperatura adecuada para evitar la hipotermia.
En términos generales, en los casos de EHRN por Rh ha de utilizarse de tipo O ne-gativa y ser siempre compatible con el suero materno. En el cuadro 13-1 se ofrece un panorama más amplio con respecto a las diferentes opciones que pueden ser utilizadas. Es también muy importante poder determinar y tratar de corregir problemas relacionados que con frecuencia están presentes, ya que su aparición hace aún más complicado el tratamiento de la HBB; entre estos factores se incluye la acidosis metabólica, sepsis, hipoxia, síndrome de dificultad respiratoria (síndrome apneico) y la prematurez.
La estrecha vigilancia requerida durante y después del procedimiento obliga a efectuarlo en unidades de cuidados intensivos neonatales perfectamente bien equipadas. Por úl-timo, es necesario subrayar que las medidas preventivas son el mejor tratamiento para este trastorno y es hacia éstas adonde el médico debe dirigir su mayor esfuerzo.
Bibliografía
- Ramasethu J, Luban NLC.Alloimmune hemolytic disease of the newborn. En: Lichtman MA, Beutler E, Kipps TL (eds.). Williams Hematology. 7a. ed. New York: McGraw-Hill, 2006;751-765.
- Edder AF, Manno CS.Alloimmune hemolytic disease of the fetus and the newborn. En: Greer JP, Foerster J, Lukens JN, Rodgers GM, Paraskevas F, Glader B (eds.). Wintrobe’s Clinical Hematology. New York: 11a. ed. Lippincott Williams and Wilkins, 2004;1183.
- Gottstein R, Cooke R. Systematic review of intravenous immunoglobulin in haemolytic disease of the newborn. Arch Dis Child Fetal Neonatal, 2003;88:F6.
- Liley HG. Immune hemolytic disease. En: Nathan DG, Orkin SH, Gins-burg D, Look AT (eds.). Hematology of infancy and childhood. 6a. ed. Philadelphia: Saunders, 2003;56.
- Hoffbrand AV, Pettit JE, Moss PAH. Pregnancy and paediatric haemato-logy. En: Hoff brand AV, Pettit JE, Moss PAH (eds.). Essential haema-tology. 4a. ed. London: Blackwell Science, 2001;319.
- Peterec SM.Management of neonatal Rh disease. Clin Perinatol, 1995;22:561-567.
- Urbaniak SJ. Alloimmunity to Rh D in humans. Tranfus Clin Biol, 2006;