Enlace covalente
| ||||||
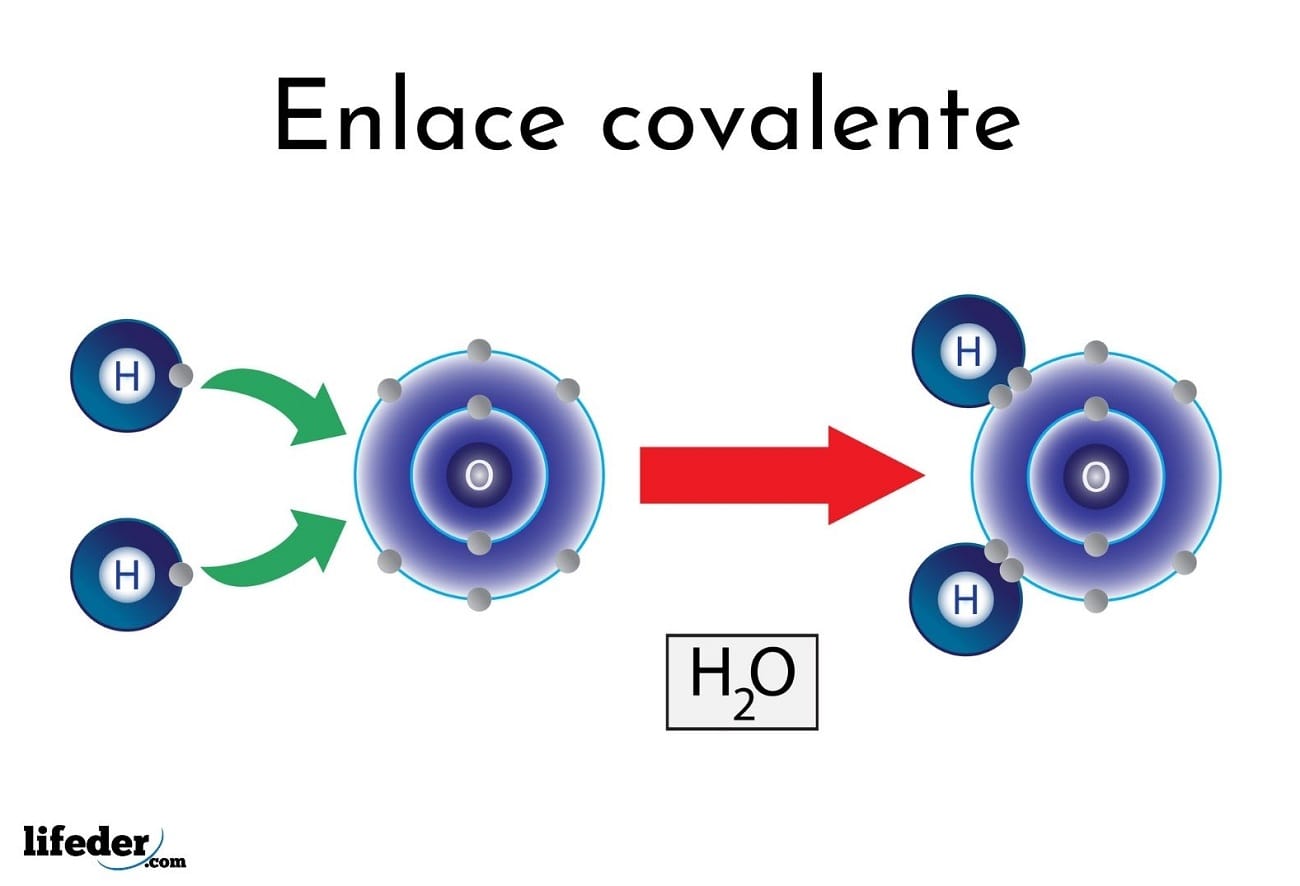
Enlace covalente,se forma por compartición de uno o más pares de electrones entre los átomos de diferente o igual electronegatividad que forman la molécula.
Sumario
Estructura de las sustancias
El enlace covalente es característico de la unión de los elementos químicos no metálicos entre si, que no difieren grandemente en sus energías de ionización y electrafinidades.
sustancias moleculares
====Propiedades====.
- Son las habituales de los enlaces covalentes:
- Temperaturas de fusión bajas. A temperatura ambiente se encuentran en estado gaseoso, líquido (volátil) o sólido de bajo punto de fusión.
- La temperaturas de ebullición son igualmente bajas.
- No conducen la electricidad en ningún estado físico dado que los electrones del enlace están fuertemente localizados y atraídos por los dos núcleos de los átomos que los comparten.
- Son muy malos conductores del calor.
- La mayoría son poco solubles en agua. Cuando se disuelven en agua no se forman iones dado que el enlace covalente no los forma, por tanto, si se disuelven tampoco conducen la electricidad.
Sólidos covalentes o redes covalentes
[[Imagen: Sustanc_covalente_atomica.jpg|thumb|right|200px|Estructura del sólido covalente Silicio
En los sólidos covalentes no se forman moléculas. Los enlaces covalentes permiten asociaciones de grandes e indeterminadadas cantidades de átomos iguales o diferentes cuando esto ocurre no se puede hablar de moléculas, sino de redes cristales covalentes. La fórmula de las redes covalentes es al igual que la de las sustancias iónicas, una fórmula empírica.
====Propiedades====
Algunas son similares a las de las sustancias moleculares
* No conducen el calor ni la electricidad
- Son insolubles en agua.
A diferencia de las sustancias moleculares:
- Presentan temperaturas de fusión y ebullición muy elevadas.
* Son sólidos a temperatura ambiente.
- Son muy duros (resistencia a ser rayado).
Tipos de enlace covalente
Tipos de enlace
Dependiendo de la diferencia de electronegatividad, el enlace covalente puede ser clasificado en covalente puro o apolar y covalente polar. Si la diferencia de electronegatividad es inferior a 0,4 es covalente apolar , y si está entre 0,4 y 1,7 es un enlace covalente polar.
Covalente apolar
Conocido además por enlace covalente puro , o covalente no polar. Se produce por el compartimiento de electrones entre dos o más átomos de igual electronegatividad, por lo que su resultado es 0, y por tanto la distribución de carga electrónica entre los núcleos es totalmente simétrica. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace covalente apolar. Ejemplo:En la molécula de dihidrogeno (H2) ambos átomos tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar.
Covalente polar
Es una transición entre el enlace iónico puro y el enlace covalente apolar. Se produce por el compartimiento de electrones entre dos o más átomos de diferente electronegatividad, estableciéndose una separación de cargas (que simbolizaremos como d+y d-) o lo que es igual, la distribución de carga electrónica entre los núcleos será asimétrica, pero esta diferencia no llega al punto en que el enlace se torna iónico puro. Son posibles diferentes grados de polaridad del enlace.Esto ocurre, porque en las sustancias que presentan enlace covalente un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace covalente polar, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones de este tipo de enlace.
La característica más importante del enlace covalente polar, es el grado de simetría en la posición del par electrónico. Esto está primeramente determinado por la diferencia de electronegatividad de los átomos. Cuanto mayor es esta diferencia, más asimétrica es la posición del par de electrones del enlace y más polar el enlace formado.
Así pues, para diferencias de electronegativades mayores de 3 el enlace será predominantemente de carácter iónico, como sucede entre el oxígeno o flúor con los elementos de los grupos 1 y 2 de la tabla periódica de 18 columnas; sin embargo, cuando está entre 0 y 1,7 será el carácter covalente el que predomine, como es el caso del enlace C-H. No obstante, según el químico Raymond Chang, esta diferencia de electronegatividad entre los átomos debe ser 2,0 o mayor para que el enlace sea considerado iónico.
Covalente coordinado o dativo
Se produce cuando un átomo comparte los dos electrones para uno solo y se suele representar con una flecha (→)
Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado. Por ejemplo:
La formación de ión amonio (NH4+1). El átomo de nitrógeno tiene un par de electrones no compartidos con otro elemento; sin embargo, este par genera un polo negativo que atrae iones positivos como H+1, el cual forma un enlace con ambos electrones que son del nitrógeno.
Enlaces múltiples
Es el compartimiento de más de un par de electrones entre dos átomos durante la formación de los enlaces covalentes, para satisfacer la regla del octeto y los requerimientos de covalencia.
El número de enlaces covalentes formados por un átomo se llama su covalencia. Es decir, la covalencia es igual al número de electrones que el átomo necesita para ser isoelelectrónico con un gas noble. Los valores para algunos de los elementos más comunes son los siguientes: hidrógeno y los halógenos, 1; oxígeno y azufre, 2: nitrógeno y fósforo, 3; carbono y silicio,4.
De esta forma se distingue entre enlace simple o sencillo (los átomos comparten un solo par de electrones de la capa de valencia), enlace doble (los átomos comparten dos pares de electrones de la capa de valencia) o enlace triple (los átomos comparten tres pares de electrones de la capa de valencia). En química orgánica las moléculas que poseen enlace simple reciben el nombre de saturadas y las que contienen enlaces múltiples no saturadas. Ejemplo
| Sustancia | Tipo de enlace | e- de valencia compartidos | Produciendo | Diagrama de Lewis | Diagrama de Couper |
|---|---|---|---|---|---|
.. .. :O=C=O: |
.. ..
|
||||
Modelo de enlace
En la actualidad existen dos teorías para explicar el enlace covalente: la Teoría del Enlace de Valencia y la Teoría de Orbitales Moleculares. Es preciso hacer notar que ninguna de las dos teorías es "mejor" que la otra, y que cada una de ellas puede ser más adecuada en función del parámetro, del cálculo o de la propiedad que se esté estudiando. Así, por ejemplo, si se trata de determinar la geometría molecular o la energía de disociación, propiedades del estado fundamental de la molécula, es más conveniente emplear la Teoría del Enlace de Valencia. En cambio, si se trata de explicar solo el aspecto energético del enlace covalente, es preferible emplear la Teoría de Orbitales Moleculares. En realidad ambas teorías son incluso complementarias, hasta tal punto que no utilizar ambas supondría limitar las herramientas disponibles para el estudio del enlace.
Teoría del Enlace de Valencia (T.E.V.)
La Teoría del Enlace de Valencia fue la primera teoría, basada en lamecánica cuántica, que se desarrolló para explicar el enlace en las moléculas covalentes. Se puede considerar que expresa el concepto de Lewis del enlace en términos de las funciones de ondas. En 1927,Heitler y London propusieron un tratamiento mecano-cuántico para la molécula de hidrógeno, que fue posteriormente desarrollado por investigadores como Pauling y Slater, entre otros, esta teoría tiene en cuenta:
1.- El pareamiento de espines electrónicos de ambos átomos.
2.- La máxima interpretación posible de los orbitales atómicos.
3.- La producción de una nube electrónica común entre ambos átomos
Tipo de enlaces y reactividad de una sustancia
Según la T.E.V. (Teoría del Enlace de valencia) la compartición de electrones en un enlace covalente se produce por el solapamiento de dos orbitales de dos átomos que están semiocupados (en cuyo caso el [[spin] del electrón de cada orbital ha de ser antiparalelo) o de un orbital lleno y otro vacío. El enlace formado en este último caso recibe el nombre de enlace covalente coordinado o dativo. En cualquier caso, el solapamiento puede ser: fontal o lateral
Solapamiento Frontal
En los enlaces covalente sigma pueden ocurrir las siguientes reacciones químicas:
- Sustitución, donde un átomo es sustituido por otro. Lo reemplaza.
- Eliminación, donde un átomo se elimina de la molécula. Generalmente en esta reacción se forma un enlace pi.
=====Solapamiento Lateral===== si los dos orbitales atómicos se superponen paralelamente, de forma que la densidad electrónica sea máxima por encima y por debajo de la línea internuclear. Este enlace se denomina pi(p), y es más débil (su energía de enlace es menor) que el s.
Los enlaces sigma no polares de un átomo saturado son muy poco reactivos y para fines prácticos podemos considerarlos inertes.
Los enlaces sigma no polares que entran a un átomo insaturado son algo más reactivos, por el efecto del enlace pi.
Los enlaces sigma polares son reactivos.
Los enlaces pi son reactivos.
Teoría de Orbitales Moleculares
Esta teoría se conoce como Teoría de Orbitales Moleculares de Hund y Mulliken, considera a la molécula como un todo y “coloca” a los electrones en orbitales moleculares, de manera similar a como se van situando los electrones en un átomo. .
Según esta teoría la combinación de dos [[orbital]es atómicos da lugar al surgimiento de dos orbitales moleculares, de diferente energía.
Orbital molecular enlazante. Es el orbital molecular de menor energía que se forma a partir de dos orbitales atómicos.
Orbital molecular antienlazante.Es el orbital molecular de mayor energía que se forma a partir de dos orbitales atómicos.
Representándose estos orbitales mediante un diagrama energético en lo que muestran los niveles de energía de los orbitales moleculares, siguiendo reglas similares a las aplicadas en el llenado de los orbitales atómicos.
Referencias
- Colectivo de autores: Química. Tomo I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1969.
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros; Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1985.
- Mahan, B.H: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1975.
Fuentes
- http://www.unalmed.edu.co/~cgpaucar/ENLACES.html
- http://www.visionlearning.com/library/module_viewer.php?mid=55&l=s
- http://www.sabelotodo.org/materia/enlaces.html
- http://usuarios.multimania.es/ptro2/fourphotogalery.html
Enlace relacionado