Diferencia entre revisiones de «Enlace iónico»
| Línea 57: | Línea 57: | ||
Mediante una transferencia de un electrón al [[cloro]] de cada [[sodio]] adquiere la distribución del [[neón]] Na[Ne]3s<sup>1</sup> ®Na<sup>+1</sup> [Ne]+ e<sup>-</sup>Mediante la transferencia de un [[electrón]] del [[sodio]], el [[cloro]] adquiere la distribución del [[argón]] Cl [Ne]3s<sup>2</sup>3p<sup>5</sup> + e<sup>-</sup>®Cl<sup>-1</sup> [Ar].<br> | Mediante una transferencia de un electrón al [[cloro]] de cada [[sodio]] adquiere la distribución del [[neón]] Na[Ne]3s<sup>1</sup> ®Na<sup>+1</sup> [Ne]+ e<sup>-</sup>Mediante la transferencia de un [[electrón]] del [[sodio]], el [[cloro]] adquiere la distribución del [[argón]] Cl [Ne]3s<sup>2</sup>3p<sup>5</sup> + e<sup>-</sup>®Cl<sup>-1</sup> [Ar].<br> | ||
Cada ión de [[sodio]] es atraído igualmente por todos sus iones de [[cloro]] vecinos, y de la misma manera por la atracción del [[cloruro de sodio]]. El concepto de una sola [[molécula]] no aplica a cristales iónicos porque el sólido existe como un [[sistema]] continuo. Sólidos iónicos forman cristales con altos puntos de fusión debido a las grandes fuerzas entre dos iones vecinos. <br> | Cada ión de [[sodio]] es atraído igualmente por todos sus iones de [[cloro]] vecinos, y de la misma manera por la atracción del [[cloruro de sodio]]. El concepto de una sola [[molécula]] no aplica a cristales iónicos porque el sólido existe como un [[sistema]] continuo. Sólidos iónicos forman cristales con altos puntos de fusión debido a las grandes fuerzas entre dos iones vecinos. <br> | ||
| + | Esta estructura está basada en un [[empaquetamiento]] [[cúbico]] compacto (centrado en las caras) de los aniones y en el que los cationes ocupan todos los huecos octaédricos. La interpretación opuesta es igualmente válida: estructura de empaquetamiento compacto de cationes con los aniones ocupando los [[huecos octaédricos]].[[Imagen: Huecos_octaédricos.jpg|thumb]] | ||
| + | En cada celda unidad los iones de un tipo ocupan los vértices y los centros de las caras del cubo mientras que los de signo contrario se sitúan en los centros de las aristas y en el centro del cubo como muestra la figura. <br> | ||
| + | Cada ion de un signo está rodeado de 6 iones de signo contrario, por lo que el número de coordinación del catión y del anión en este tipo de estructura de 6. Se dice que la estructura presenta coordinación (6,6), donde el primer dígito representa el número de coordinación del catión y el segundo el del anión. Los seis iones de signo contrario que rodean a un ion central se disponen en forma octaédrica. Este tipo de estructura es adoptada por la mayoría de los haluros alcalinos como los de Li, Na, K, Rb y el CsF. También es adoptada por los óxidos de Mg, Ca, Sr, Ba y Cd. | ||
| + | ====Propiedades====. | ||
| + | * Tienden a formar sólidos cristalinos con temperaturas muy altas | ||
| + | * Son sólidos estables de estructura [[cristalina]] en el [[sistema cúbico]], como consecuencia de las atracciones electrostáticas entre los iones de cargas contrarias.<br/> | ||
| + | * Los cristales iónicos son frágiles y pueden experimentar fracturas a lo largo de determinados planos del cristal. <br/> | ||
| + | * Son [[solubles]], en [[agua]] y otros [[solventes]] polares, siendo pequeña su solubilidad en los [[disolventes orgánicos]]. <br/> | ||
| + | * Altos [[puntos de fusión]] (entre 300 [[°C ]]o 1000 °C) y [[ebullición]]. <br/> | ||
| + | Sin embargo existen excepciones como el CaF2 el cual presenta un elevado punto de fusión pero es insoluble en [[agua]]. Los compuestos iónicos también presentan una baja conductividad eléctrica en el estado sólido pero se hacen buenos conductores de la electricidad cuando se funden o cuando se disuelven en disolventes polares como el agua. <br/> | ||
| + | * Una vez fundidos o en [[solución acuosa]], conducen la [[electricidad]], pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal. <br/> | ||
| + | * Los sólidos iónicos presentan estructuras con bajos números de coordinación, a diferencia de los sólidos metálicos, lo que explica su menor densidad.<br/> | ||
| + | De hecho, la distinción entre un sólido iónico y uno covalente puede establecerse en función del número de coordinación, al que puede llegarse de forma experimental mediante técnicas de difracción de rayos X. Sin embargo, algunos sólidos covalentes como el diamante presentan también bajos números de coordinación, por lo que es necesario un criterio más específico para establecer un sólido como iónico. <br/> | ||
== Referencias== | == Referencias== | ||
*Colectivo de autores: [[Química]]. Tomo I. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1969]]. <br> | *Colectivo de autores: [[Química]]. Tomo I. Ed. Pueblo y Educación. [[Ciudad de La Habana]], [[Cuba]]. [[1969]]. <br> | ||
Revisión del 11:34 14 oct 2011
| ||||||
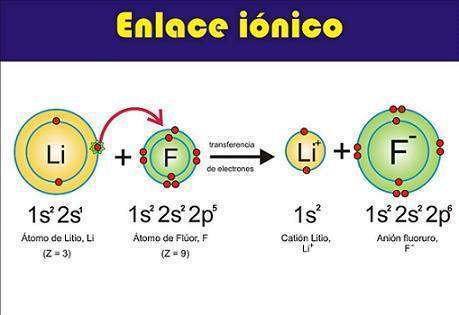
Enlace iónico o electrovalente. En química, es una unión de partículas que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Cuando una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales, elementos de elevadas electronegatividades y afinidad electrónica , los cuales se transforman en iones con carga negativa; los metales, con energía de ionización pequeña , a su vez, se convierten en iones con carga positiva. Entonces, los iones de diferente signo se atraen electrostáticamente, formando enlaces iónicos.
Sumario
Sustancias iónicas
Las partículas que componen a las sustancias sólidas pueden ser: iones, átomos, moléculas, de acuerdo con la naturaleza de la misma. Dichas partículas, al estar dispuestas en el espacio a determinada distancia y con un cierto orden, forman una red cristalina, en cuyos nudos se encuentran ellas.
La característica principal de un sólido, es la disposición de sus átomos e iones que conducen a la formación del cristal. Esta disposición suele representarse por medio de esferas sólidas. Un cristal de un compuesto iónico puede considerarse, desde el punto de vista formal de su construcción, como la repetición regular de unidades asimétricas, que pueden ser átomos, moléculas o iones.
La disposición de los iones en el edificio cristalino o red cristalina de un sólido iónico debe ser tal, que garantice una máxima estabilidad del cristal correspondiente a una mayor disminución de energía y el máximo valor posible de la energía reticular.
El enlace iónico involucra la formación de un sólido cristalino ordenado, en el que se distribuyen espacialmente los cationes y los aniones siguiendo un patrón similar al de un papel mural, pero dispuestos de manera tridimensional. En un compuesto iónico hay un completo balance de la carga eléctrica. Así por ejemplo,
Si se dispone de iones aluminio (III) (Al+3) y óxido (O-2), la condición de electro neutralidad se puede expresar de este modo: si en un cristal de óxido de aluminio hay iones Al3+ y iones O-2, entonces para que exista neutralidad deberán existir dos iones Al+3 y tres iones O-2- en el compuesto sólido Al2O3.
Estructura
La fórmula de los compuestos iónicos, indican la relación que existe entre los iones que forman estos compuestos. Las sustancias iónicas, forman cristales de diversas formas geométricas, en lo que las partículas fundamentales son iones, que se mantienen unidos por fuerzas electrostáticas ejercidas en todas las direcciones del espacio, desde cada ion en particular, a continuación se muestra distintos tipos de estructuras iónicas.
| Tipo de estructura | Coordinacion | Tipo de cristalización | Ejemplos |
|---|---|---|---|
Catión:6 |
|||
Catión:8 |
CsBr CsI | ||
Catión:4 |
|||
Catión:8 |
|||
Catión:6 |
MnO2 IrO2 etcétera |
Las consideraciones anteriores en relación con las estructuras de las redes cristalinas iónicas permiten comprender que en los sólidos iónicos existe un empaquetamiento de iones lo mas compacto posible, en dependencia de las cargas y de los radios de los iones.
En este empaquetamiento las fuerzas que mantienen unidos a los iones son fuerzas de atracción entre cargas eléctricas las cuales no se producen en una dirección determinada, sino en todas las direcciones del espacio a partir de cada ion. Todo esto permite explicar las propiedades características de los sólidos que presentan enlace iónico
La estructura que se describirá es el modelo que describe a un gran número de sólidos iónicos.
Estructura del cloruro de sodio
La estructura de la sal de roca, que toma su nombre de la forma mineral del NaCl, es característica de muchos otros sólidos iónicos. Muchas de las estructuras pueden considerarse constituidas por redes formadas por iones positivos y negativos en las que se maximizan las fuerzas atractivas entre iones de signos opuestos y se minimizan las fuerzas repulsivas entre iones de la misma carga.
Mediante una transferencia de un electrón al cloro de cada sodio adquiere la distribución del neón Na[Ne]3s1 ®Na+1 [Ne]+ e-Mediante la transferencia de un electrón del sodio, el cloro adquiere la distribución del argón Cl [Ne]3s23p5 + e-®Cl-1 [Ar].
Cada ión de sodio es atraído igualmente por todos sus iones de cloro vecinos, y de la misma manera por la atracción del cloruro de sodio. El concepto de una sola molécula no aplica a cristales iónicos porque el sólido existe como un sistema continuo. Sólidos iónicos forman cristales con altos puntos de fusión debido a las grandes fuerzas entre dos iones vecinos.
En cada celda unidad los iones de un tipo ocupan los vértices y los centros de las caras del cubo mientras que los de signo contrario se sitúan en los centros de las aristas y en el centro del cubo como muestra la figura.
Cada ion de un signo está rodeado de 6 iones de signo contrario, por lo que el número de coordinación del catión y del anión en este tipo de estructura de 6. Se dice que la estructura presenta coordinación (6,6), donde el primer dígito representa el número de coordinación del catión y el segundo el del anión. Los seis iones de signo contrario que rodean a un ion central se disponen en forma octaédrica. Este tipo de estructura es adoptada por la mayoría de los haluros alcalinos como los de Li, Na, K, Rb y el CsF. También es adoptada por los óxidos de Mg, Ca, Sr, Ba y Cd.
====Propiedades====.
- Tienden a formar sólidos cristalinos con temperaturas muy altas
- Son sólidos estables de estructura cristalina en el sistema cúbico, como consecuencia de las atracciones electrostáticas entre los iones de cargas contrarias.
- Los cristales iónicos son frágiles y pueden experimentar fracturas a lo largo de determinados planos del cristal.
- Son solubles, en agua y otros solventes polares, siendo pequeña su solubilidad en los disolventes orgánicos.
- Altos puntos de fusión (entre 300 °C o 1000 °C) y ebullición.
Sin embargo existen excepciones como el CaF2 el cual presenta un elevado punto de fusión pero es insoluble en agua. Los compuestos iónicos también presentan una baja conductividad eléctrica en el estado sólido pero se hacen buenos conductores de la electricidad cuando se funden o cuando se disuelven en disolventes polares como el agua.
- Una vez fundidos o en solución acuosa, conducen la electricidad, pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
- Los sólidos iónicos presentan estructuras con bajos números de coordinación, a diferencia de los sólidos metálicos, lo que explica su menor densidad.
De hecho, la distinción entre un sólido iónico y uno covalente puede establecerse en función del número de coordinación, al que puede llegarse de forma experimental mediante técnicas de difracción de rayos X. Sin embargo, algunos sólidos covalentes como el diamante presentan también bajos números de coordinación, por lo que es necesario un criterio más específico para establecer un sólido como iónico.
Referencias
- Colectivo de autores: Química. Tomo I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1969.
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1985.
* Mahan, B.H: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1975.
Fuentes
- http://www.unalmed.edu.co/~cgpaucar/ENLACES.html
- http://www.visionlearning.com/library/module_viewer.php?mid=55&l=s
- http://www.textoscientificos.com/quimica/inorganica/enlace-ionico.
- http://www.elergonomista.com/quimica/ionico.html
Enlace relacionado