Diferencia entre revisiones de «Enlace químico»
| Línea 14: | Línea 14: | ||
OH(g) = O(g) + H(g) ε (O-H) = 462,9 Kj.mol<sup>-1</sup> (3) <br> HOOH = HOO(g) + H(g) ε (HOO-H) = 497 Kj.<sup>-1 </sup> (4) <br>Al observar las ecuaciones (1), (3), y (4), estas se refieren a la ruptura de un mismo enlace (O-H) y es claro que la diferencia entre los tres valores se debe, no a los átomos enlazados, sino a las diferentes estructuras de las agrupaciones próximas al enlace. Eso no obstante, las diferencias en los valores, no son muy grandes en los 3 casos. Cada enlace en cada molécula tiene su propia energía de disociación de enlace específica. Por ello no es sorprendente que los enlaces entre los mismos tipo de átomos tengan usualmente energía de disociación similar. Por ejemplo, los enlaces [[Carbono]]-carbono (C-C) tienen un valor de de aproximadamente 350-380 kJ.mol<sup>-1</sup> independiente de la estructura exacta de la molécula. Igual sucede en una serie de enlaces C-H.<br> CH<sub>4</sub>(g) = CH<sub>3</sub>(g) + H(g) ε (H-CH<sub>3</sub>) = 431.055Kj.mol<sup>-1</sup><br> CH<sub>3</sub>CH<sub>3</sub>(g) = H<sub>3</sub>CH<sub>2</sub>(g) + H(g) ε (H-C2H5) = 361.760 Kj.mol<sup>-1</sup><br> (CH<sub>3</sub>)<sub>3</sub>(g) = (CH<sub>3</sub>)<sub>3</sub>C(g) + H(g) ε (H-C-(CH<sub>3</sub>)<sub>3</sub> = 336.650 Kj.mol<sup>-1 <br></sup> | OH(g) = O(g) + H(g) ε (O-H) = 462,9 Kj.mol<sup>-1</sup> (3) <br> HOOH = HOO(g) + H(g) ε (HOO-H) = 497 Kj.<sup>-1 </sup> (4) <br>Al observar las ecuaciones (1), (3), y (4), estas se refieren a la ruptura de un mismo enlace (O-H) y es claro que la diferencia entre los tres valores se debe, no a los átomos enlazados, sino a las diferentes estructuras de las agrupaciones próximas al enlace. Eso no obstante, las diferencias en los valores, no son muy grandes en los 3 casos. Cada enlace en cada molécula tiene su propia energía de disociación de enlace específica. Por ello no es sorprendente que los enlaces entre los mismos tipo de átomos tengan usualmente energía de disociación similar. Por ejemplo, los enlaces [[Carbono]]-carbono (C-C) tienen un valor de de aproximadamente 350-380 kJ.mol<sup>-1</sup> independiente de la estructura exacta de la molécula. Igual sucede en una serie de enlaces C-H.<br> CH<sub>4</sub>(g) = CH<sub>3</sub>(g) + H(g) ε (H-CH<sub>3</sub>) = 431.055Kj.mol<sup>-1</sup><br> CH<sub>3</sub>CH<sub>3</sub>(g) = H<sub>3</sub>CH<sub>2</sub>(g) + H(g) ε (H-C2H5) = 361.760 Kj.mol<sup>-1</sup><br> (CH<sub>3</sub>)<sub>3</sub>(g) = (CH<sub>3</sub>)<sub>3</sub>C(g) + H(g) ε (H-C-(CH<sub>3</sub>)<sub>3</sub> = 336.650 Kj.mol<sup>-1 <br></sup> | ||
| + | <br>Es evidente que todos los valores aun cuando diferentes se encuentran entre 336,650 y 431,055 Kj.mol</sup>-1</sup> y la constante aproximada de estas energías, es muy significativa ya que sugiere que el factor principal para determinara la energía de un enlace particular, es la naturaleza de los átomos enlazados y en menor extensión las estructuras de las agrupaciones próximas al enlace. | ||
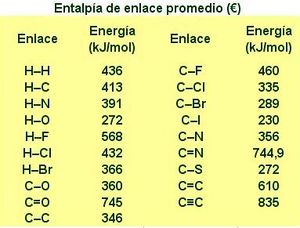
| + | Debido a que enlaces similares tienen energía de disociación similares, es posible construir una tabla de valores promedios que permite comparar diferentes clases de enlaces. Hay que tener en cuanta no obstante que el valor real en una molécula específica puede variar en un 10 % en promedio, porque el valor concreto de la energía depende del entorno químico de los átomos enlazados. | ||
| + | [[Image: Entalpia_de_enlace_promedio.JPG|thumb|center| 383 × 291]] | ||
| + | Empleando las entalpías de enlace promedio es posible estimar, de manera aproximada, la energía que se libera cuando se forma una molécula gaseosa a partir de sus átomos en estado gaseoso. | ||
| + | Ejemplo | ||
| − | |||
| − | |||
| − | |||
| − | |||
== Fuente ==<br>*http://definicion.de/ley-periodica/<br><br>*http://www.portalplanetasedna.com.ar/mendeleiev.htm <br>*http://www.fq.uh.cu/dpto/qf/uclv/infoLab/infoquim/asig_programs/prog.lic.quimica/temas/estruc_atom_ley_period.htm<br>*http://quimica-general.net16.net/ley_periodica.html<br>*http://www.xtec.cat/~bnavarr1/Tabla/castellano/moseley.htm<br>*http://es.wikipedia.org/wiki/%C3%81ngulo_de_enlace<br>* Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.<br>*Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.<br>*León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985.<br>*León, R: Química General Superior. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.<br>== Enlaces externos ==<br>*[http://thales.cica.es/rd/Recursos/rd99/ed99-0276-02/energia6.htm]<br>*[ http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja12a2P1.html]<br><br> <br><br> | == Fuente ==<br>*http://definicion.de/ley-periodica/<br><br>*http://www.portalplanetasedna.com.ar/mendeleiev.htm <br>*http://www.fq.uh.cu/dpto/qf/uclv/infoLab/infoquim/asig_programs/prog.lic.quimica/temas/estruc_atom_ley_period.htm<br>*http://quimica-general.net16.net/ley_periodica.html<br>*http://www.xtec.cat/~bnavarr1/Tabla/castellano/moseley.htm<br>*http://es.wikipedia.org/wiki/%C3%81ngulo_de_enlace<br>* Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.<br>*Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.<br>*León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985.<br>*León, R: Química General Superior. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.<br>== Enlaces externos ==<br>*[http://thales.cica.es/rd/Recursos/rd99/ed99-0276-02/energia6.htm]<br>*[ http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja12a2P1.html]<br><br> <br><br> | ||
[[Category:Química_inorgánica]]<br>[[Category:Química_inorgánica|Química_inorgánica]] | [[Category:Química_inorgánica]]<br>[[Category:Química_inorgánica|Química_inorgánica]] | ||
Revisión del 10:25 11 may 2011
Enlace químico
Historia
Las primeras especulaciones respecto a la naturaleza del enlace químico son tan tempranas como en el siglo XII, se suponía que ciertos tipos de especies químicas estaban unidas entre sí por un tipo de afinidad química. En 1704, Isaac Newton esbozó su teoría de enlace atómico, en "Query 31" de su Opticks, donde los átomos se unen unos a otros por alguna "fuerza". Específicamente, después de investigar varias teorías populares, en boga en aquel tiempo, de cómo los átomos se podía unir unos a otros, por ejemplo, "átomos enganchados", "átomos pegados unos a otros por reposo", o "unidos por movimientos conspirantes", Newton señaló lo que inferiría posteriormente a partir de su cohesión que:Las partículas se atraen unas a otras por alguna fuerza, que en contacto inmediato es excesivamente grande, a distancias pequeñas desempeñan operaciones químicas y su efecto deja de sentirse no lejos de las partículas.En 1819, a raíz de la invención de la pila voltaica, Jöns Jakob Berzelius desarrolló una teoría de combinación química, introduciendo indirectamente el carácter electropositivo y electronegativo de los átomos que se combinan. A mediados del siglos XIX, Edward Frankland, F.A. Kekule, A.S. Couper, A.M. Butlerov y Hermann Kolbe, ampliando la teoría de radicales, desarrollaron la teoría de valencia, originalmente llamado "poder combinante" en que los compuestos se mantenía unidos debido a la atracción entre polos positivo y negativo. En 1916, el químico Gilbert N. Lewis desarrolló el concepto de enlace de par de electrones, en el que dos átomos pueden compartir uno y seis electrones, formando el enlace de un solo electrón, enlace simple, enlace doble, o enlace triple. En las propias palabras de Lewis: ”Un electrón puede formar parte de las envolturas de dos átomos diferentes y no puede decirse que pertenezca a uno exclusivamente. El mismo año, Walther Kossel lanzó una teoría similar a la de Lewis, con la diferencia de que su modelo asumía una transferencia completa de electrones entre los átomos, con lo que era un modelo de enlace iónico. Tanto Lewis y Kossel estructuraron sus modelos de enlace a partir de la regla de Abegg (1904). .</div>En 1927, el físico danés Oyvind Burrau derivó la primera descripción cuántica matemáticamente completa de un enlace químico simple, el producido por un electrón en el ion de Hidrógeno molecular (dihidrogenilio), Hidrógeno H2 Este trabajo mostró que la aproximación cuántica a los enlaces químicos podrían ser correctas fundamental y cualitativamente, pero los métodos matemáticos usados no podrían extenderse a moléculas que contuvieran más de un electrón. Una aproximación más práctica, aunque menos cuantitativa, fue publicada en el mismo año por Walter Heitler y Fritz London. El método de Heitler-London forma la base de lo que ahora se denomina teoría del enlace de valencia. En 1929, Sir John Lennard-Jones introdujo el método de combinación lineal de orbitales atómicos (CLOA o dentro de la teoría de orbitales moleculares, sugiriendo también métodos para derivar las estructuras electrónicas de moléculas de F2 (flúor) y las moléculas de O2 (El oxígeno , a partir de principios cuánticos básicos. Esta teoría de orbital molecular representó un enlace covalente como un orbital formado por combinación de los orbitales atómicos de la mecánica cuántica de Erwin Schrödinger que habían sido hipotetizados por los electrones en átomos solitarios. Las ecuaciones para los electrones de enlace en átomos multielectrónicos no podrían ser resueltos con perfección matemática (esto es, analíticamente), pero las aproximaciones para ellos aún producen muchas predicciones y resultados cualitativos buenos. Muchos cálculos cuantitativos en química cuántica moderna usan tanto las teorías de orbitales moleculares o de enlace de valencia como punto de partida, aunque una tercera aproximación, la teoría del funcional de la densidad, se ha estado haciendo más popular en años recientes. <La pequeñez de la masa de los constituyentes, y en especial del electrón, hace que solamente les sea aplicable la mecánica cuántica y, por tanto, la descripción matemática del enlace es generalmente complicada. La teoría cuántica del enlace es la base de la teoría moderna de la valencia.
Definición de enlace químico
Si bien es difícil definir el concepto de enlace químico, podemos referirnos a la definición que del mismo hizo Linus Pauling to the side, una de las personalidades más destacadas de la ciencia en los últimos años del siglo XX, él planteaba que “Existe un enlace químico entre dos átomos cuando las fuerzas que actúan entre ellos son de una intensidad tal que se forma un agregado con estabilidad suficiente para que pueda ser considerado por el químico como una especie independiente”, partiendo de lo anterior , se define al enlace químico como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial de electrones para adquirir ambos la configuración electrónica estable correspondiente a los gases inerte; es decir, el enlace es el proceso por el cual se unen átomos iguales o diferentes para adquirir la configuración electrónica estable de los gases inertes y formar moléculas estables.
Características principales del enlace químico
Aunque el enfoque cuantitativo de las teorías del enlace químico supone una rigurosa aplicación de la Mecánica Cuántica, las ideas sobre el enlace químico con las cuales trabajan la mayor parte de los químicos, han sido desarrolladas tratando de usar conceptos cualitativos, a fin de explicar los hechos experimentales. Es decir, que son los datos experimentales sobre las estructuras moleculares, las que deben servir de guía en la confección de una teoría sobre enlace químico.En cualquier sustancia, independientemente del tipo de partículas que la constituyan, átomos, moléculas o iones, hay varios parámetros que permiten caracterizar su estructura, de forma tal que coincida ésta en muchos casos pueden predecirse con gran certeza sus propiedades. Los parámetros fundamentales del enlace químico los constituyen la longitud o distancia, la solidez o energía de enlace y la dirección o ángulo del mismo.
Energía de enlace
Es la energía total promedio que se desprendería por la formación de un mol de enlaces químicos, a partir de sus fragmentos constituyentes (todos en estado gaseoso). Alternativamente, podría decirse también que es la energía total promedio que se necesita para romper un mol de enlaces dado (en estado gaseoso). Cuanto más elevada sea la energía de enlace, más fuerte y más estable será dicho enlace.Energía de enlace en moléculas diatómicas Para una molécula diatómica:”la variación de entalpía que se produce cuando la molécula en estado gaseoso se disocia en sus átomos”. En estos tipos de moléculas la energía de enlace tiene magnitud igual (pero signo contrario) al de la energía de disociación.
Usualmente la energía del enlace viene dada en Kj.mol1 de enlace rotos, o sea, que para disociar en átomos al estado gaseoso,Un mol de moléculas de hidrógeno, es decir para romper 6,02.1023enlaces se requieren 435, 2 Kj.La energía o entalpía de formación del enlace es igual pero negativa, para moléculas diatómicas, la energía de enlace es igual y de signo contrario a la energía de disociación del enlace.
Entre los haluros de hidrógeno el valor de la
Energía de enlace en moléculas poliatómicas
En las moléculas poliatómicas
– De un solo tipo de enlace:
por ejemplo en moléculas ABn, la energía media de enlace es igual a 1/n de la energía total requerida en la disociación completa de un mol del compuesto con formación de un atg. De A y n atg. De B.
- En moléculas poliatómicas en que existen más de un enlace,
es posible caracterizar cada enlace, por una entalpía de enlace promedio (ε), que es la energía aproximada que se necesita para romper el enlace en cualquier compuesto en el cual existe dicho enlace. La disociación puede referirse a la división de una molécula:
A. En un átomo y un radical:
H2O(g) = H(g) + OH(g) ε = 497 Kj.mol-1 (1)
B. En dos radicales
H2O2 (g) = OH(g) + OH(g) ε =201Kj.mol-1 (2)
También puede ocurrir la ruptura de un enlace entre dos átomos dados, pero en diferentes compuestos, y es interesante observar el efecto sobre la energía de enlace, de las diferentes agrupaciones próximas al enlace. Se conoce que el ε (H-OH) = 497 Kj.mol-1, y otros experimentos muestran que
OH(g) = O(g) + H(g) ε (O-H) = 462,9 Kj.mol-1 (3)
HOOH = HOO(g) + H(g) ε (HOO-H) = 497 Kj.-1 (4)
Al observar las ecuaciones (1), (3), y (4), estas se refieren a la ruptura de un mismo enlace (O-H) y es claro que la diferencia entre los tres valores se debe, no a los átomos enlazados, sino a las diferentes estructuras de las agrupaciones próximas al enlace. Eso no obstante, las diferencias en los valores, no son muy grandes en los 3 casos. Cada enlace en cada molécula tiene su propia energía de disociación de enlace específica. Por ello no es sorprendente que los enlaces entre los mismos tipo de átomos tengan usualmente energía de disociación similar. Por ejemplo, los enlaces Carbono-carbono (C-C) tienen un valor de de aproximadamente 350-380 kJ.mol-1 independiente de la estructura exacta de la molécula. Igual sucede en una serie de enlaces C-H.
CH4(g) = CH3(g) + H(g) ε (H-CH3) = 431.055Kj.mol-1
CH3CH3(g) = H3CH2(g) + H(g) ε (H-C2H5) = 361.760 Kj.mol-1
(CH3)3(g) = (CH3)3C(g) + H(g) ε (H-C-(CH3)3 = 336.650 Kj.mol-1
Es evidente que todos los valores aun cuando diferentes se encuentran entre 336,650 y 431,055 Kj.mol-1 y la constante aproximada de estas energías, es muy significativa ya que sugiere que el factor principal para determinara la energía de un enlace particular, es la naturaleza de los átomos enlazados y en menor extensión las estructuras de las agrupaciones próximas al enlace.
Debido a que enlaces similares tienen energía de disociación similares, es posible construir una tabla de valores promedios que permite comparar diferentes clases de enlaces. Hay que tener en cuanta no obstante que el valor real en una molécula específica puede variar en un 10 % en promedio, porque el valor concreto de la energía depende del entorno químico de los átomos enlazados.
Empleando las entalpías de enlace promedio es posible estimar, de manera aproximada, la energía que se libera cuando se forma una molécula gaseosa a partir de sus átomos en estado gaseoso. Ejemplo
== Fuente ==
*http://definicion.de/ley-periodica/<br>
*http://www.portalplanetasedna.com.ar/mendeleiev.htm
*http://www.fq.uh.cu/dpto/qf/uclv/infoLab/infoquim/asig_programs/prog.lic.quimica/temas/estruc_atom_ley_period.htm
*http://quimica-general.net16.net/ley_periodica.html
*http://www.xtec.cat/~bnavarr1/Tabla/castellano/moseley.htm
*http://es.wikipedia.org/wiki/%C3%81ngulo_de_enlace
* Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
*Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
*León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985.
*León, R: Química General Superior. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
== Enlaces externos ==
*[1]
*[ http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja12a2P1.html]
<br>
<br>