Ley de los volúmenes de combinación
| ||||
Ley de los volúmenes de combinación. Muchos de lo elementos y compuestos son gaseosos, y puesto de que es más sencillo medir un volumen que un peso de gas natural se estudiasen las relaciones de volumen en que los gases se combinan.
Al obtener vapor de agua a partir de los elementos que se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
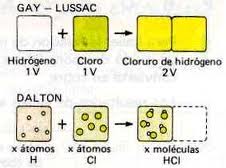
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues Gay-Lussac mostró que se cumplía en todas las reacciones en que intervienen gases.
Lussac formuló en 1808 la Ley de los volúmenes de combinación que lleva su nombre, la cual puede enunciarse como sigue: en cualquier reacción química los volúmenes de todas las sustancias gaseosas que intervienen en la misma están en una relación de números enteros sencillos.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen del azufre que se une con el oxígeno para formar anhídrido sulfuroso.
Lussac observó que el volumen de la combinación gaseosa resultante era inferior o a lo igual a la suma de los volúmenes de las sustancias gaseosas que se combinan.
Fuentes
- Joseph A. Babor, Jose Ibarz. Química General Moderna. Tomo I. Edit. 1978.
- quimicaweb