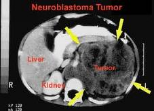
Neuroblastoma
Los neuroblastomas son tumores de células pequeñas con diferenciación neuroblástica y los ganglioneuroblastomas, una variante de los primeros, además poseen células con variado grado de diferenciación hacia células ganglionares, con citoplasma abundante y núcleos y nucleolos prominentes, que recuerdan a las neuronas de los ganglios raquídeos.
Los neuroblastomas se presentan en la primera década de la vida, generalmente antes de los 5 años, aunque se pueden hallar en adultos jóvenes. Son tumores grandes que refuerzan con contraste; son frecuentes las calcificaciones y quistes. En la TC sin contraste pueden aparecer como masas hiperdensas.
Sumario
- 1 Características
- 2 Causas, incidencia y factores de riesgo
- 3 Clasificación celular
- 4 Síntomas
- 5 Signos
- 6 Tipos de neuroblastomas biológicamente discretos
- 7 Neuroblastoma en estadio bajo
- 8 Exámenes
- 9 Regresión espontánea del neuroblastoma
- 10 Diagnóstico
- 11 Pronóstico
- 12 Factores biológicos
- 13 Estadificación del Neuroblastoma
- 14 Opciones de tratamiento
- 15 Pronóstico
- 16 Complicaciones
- 17 Situaciones que requieren asistencia médica
- 18 Bibliografía
- 19 Fuentes
Características
Macroscópicamente, son tumores bien delimitados, grises y quísticos, a veces pueden tener hemorragias y necrosis. Los neuroblastomas cerebrales varían en su aspecto histológico, presentando unas áreas fibrilares y otras densamente celulares. Las áreas fibrilares son procesos de las neuronas o neurorites y varían tanto en extensión como en configuración, incluyen los centros de las rosetas de Homer Wright, zonas perivasculares sin núcleos y grandes regiones sin patrones arquitecturales
A los neuroblastomas y ganglioneuroblastomas se los puede clasificar en clásico, transicional y desmoplásico según la cantidad de tejido conectivo que poseen y que varía de escaso a abundante y éste es más importante cuando el tumor llega a las meninges. En la forma transicional, la reticulina y el colágeno le dan un aspecto lobular, pero no tan claro como en los neuroblastomas cerebelosos.
Causas, incidencia y factores de riesgo
El neuroblastoma puede presentarse en muchas áreas del cuerpo y se desarrolla a partir de tejidos que forman el sistema nervioso simpático, que es la parte del sistema nervioso que controla funciones del organismo como la frecuencia cardiaca, la presión sanguínea, la digestión y los niveles de ciertas hormonas.
El neuroblastoma tiende a comenzar en el abdomen en los tejidos de la glándula suprarrenal, pero puede aparecer en otras áreas y puede diseminarse con rapidez a los ganglios linfáticos, el hígado, los huesos y la médula ósea.
La causa del tumor se desconoce. El neuroblastoma se diagnostica con mayor frecuencia en los niños antes de los cinco años. Este trastorno afecta aproximadamente a 1 de cada 100.000 niños y es ligeramente más común en los varones.
Clasificación celular
Un sistema clinicopatológico de estadificación comprende la evaluación de especimenes de tumores obtenidos antes de la terapia en cuanto al grado de desarrollo estromático y de maduración neuroblástica y al índice de mitosis-cariorrexis de las células neuroblásticas. Estos parámetros histológicos y la edad del paciente se usan para definir pronósticos favorables y desfavorables. Varios estudios han confirmado la importancia predictiva de este sistema de clasificación y de otros sistemas relacionados que emplean criterios similares. Los ganglioneuroblastomas, o sea los neuroblastomas que contienen muchas células diferenciadoras, pueden contener nódulos de células no diferenciadas cuya histología, junto a la amplificación de MYCN determina el pronóstico.
Síntomas
- Piel pálida
- Círculos oscuros alrededor de los ojos
- Fatiga crónica, cansancio excesivo que dura de semanas a meses
- Diarrea
- Agrandamiento del abdomen (sobre todo si hay diseminación al hígado) masa abdominal o abdomen inflamado
- Dolor o sensibilidad óseos (si el cáncer se disemina a los huesos)
- Dificultad respiratoria (si el cáncer se disemina al tórax)
- Molestia o incomodidad general (malestar general) que dura semanas o meses
- Piel sonrojada, enrojecida
- Sudoración profusa
- Pulso acelerado (taquicardia)
- Movimientos incontrolables del ojo
- Pérdida del movimiento (parálisis) en cadera, piernas o pies (extremidades inferiores)
- Movimiento descoordinado
- Irritabilidad o mal control del temperamento
Nota: los síntomas varían según la localización del tumor.
Signos
Los signos varían según la localización del tumor. El examen del abdomen con las manos (palpación) puede mostrar una masa y el hígado puede estar agrandado si el tumor se ha diseminado hasta dicho órgano. Los tumores de la Glándula suprarrenal pueden producir presión sanguínea alta y frecuencia cardiaca rápida.
Tipos de neuroblastomas biológicamente discretos
Con base en estos factores biológicos y una mejoría en el entendimiento del desarrollo molecular de las células de cresta neurales que dan origen al neuroblastoma, los tumores se han clasificado en tres grupos biológicos. Estos grupos no se utilizan para determinar el tratamiento en estos momentos. Un tipo expresa el receptor neurotrofino TrkA, es hiperdiploide y tiende a retroceder espontáneamente. Otro tipo expresa el receptor neurotrofino TrkB, ha ganado un cromosoma adicional 17q, ha perdido la heterozigocidad del 14q u 11q y es genómicamente inestable. En un tercer tipo, además de ganar el cromosoma 17q, se pierde el cromosoma 1p y el gen MYCN se amplia.
Neuroblastoma en estadio bajo
Estudios recientes han indicado que niños seleccionados que aparentemente tienen neuroblastomas asintomáticos, pequeños en estadio bajo detectados mediante tamizaje, o como un hallazgo por accidente mediante un ultrasonido, a menudo presentan tumores que manifiestan regresión espontánea y pueden observarse de manera segura sin intervención quirúrgica o diagnóstico tisular. En la actualidad, el Grupo de Oncología Infantil (COG, por sus siglas en inglés) está estudiando si es seguro simplemente observar a los neonatos con masas suprarrenales pequeñas que se presumen son neuroblastomas (COG ANBL00P2). Estas masas generalmente se encuentran durante un diagnóstico ultrasónico prenatal o incidental.
Exámenes
Los exámenes revelan el tumor original (primario) y las localizaciones de los tumores diseminados:
- Tomografía computarizada
- IRM
- Radiografía del tórax
- Gammagrafía ósea
- Biopsia de la médula ósea
- Pruebas hormonales (niveles de las hormonas como la epinefrina)
- CSC que muestra anemia u otra anomalía
- Catecolaminas en la orina
- Catecolaminas en la sangre
- Gammagrafía con MIBG (metayodobenzilguanidina)
Regresión espontánea del neuroblastoma
Este fenómeno se ha descrito bien en niños, especialmente en aquellos con el patrón 4S de diseminación metastásica. (Para mayor información, consultar la sección sobre Información sobre los estadios.) La regresión generalmente tiene lugar solo en tumores con un número aproximadamente triploide de cromosomas que también carecen de la amplificación de MYCN y pérdida del cromosoma 1p. Las características relacionadas con la regresión espontánea incluyen la falta de expresión de telomerasa, la expresión de Ha-ras, y la expresión del receptor de neurotrofina TrkA, un receptor del factor de crecimiento nervioso.
Diagnóstico
El diagnóstico del neuroblastoma requiere la participación de patólogos que estén familiarizados con tumores infantiles. Algunos neuroblastomas no pueden diferenciarse por microcospía de luz convencional, de otros tumores de células azules redondas y pequeñas de la infancia como linfomas, tumores neuroectodérmicos primitivos y rabdomiosarcomas. La prueba para efectuar la diferenciación neuronal simpática debe demostrarse por inmunohistoquímica, microscopía electrónica o concentraciones elevadas de catecolaminas séricas (por ejemplo, dopamina y noradrenalina), o por los metabolitos de las catecolaminas en la orina como el ácido vanililmandélico (VMA) o ácido homovanílico (HVA).
El criterio mínimo establecido por acuerdo internacional para diagnosticar un neuroblastoma se basa en una de las características siguientes:
(1) Un diagnóstico patológico inequívoco realizado por análisis del tejido tumoral con microscopio de luz (con o sin inmunohistología, microscopía electrónica o concentraciones elevadas de catecolaminas séricas o de metabolitos de las catecolaminas en la orina)
(2) La combinación de una muestra de médula ósea por aspiración o la biopsia por trépano que contenga células tumorales inequívocas (o sea sincitios o racimos de células inmunocitológicamente positivas) y concentraciones elevadas de catecolaminas séricas o de metabolitos de las catecolaminas en la orina como se mencionó anteriormente.
Pronóstico
Aproximadamente el 70% de los pacientes con neuroblastoma presentan enfermedad metastásica al momento del diagnóstico. El pronóstico de los pacientes con neuroblastoma está relacionado con su edad al momento del diagnóstico, el estadio clínico de la enfermedad y en los pacientes mayores de un año de edad la afectación de los ganglios linfáticos regionales. Otras variables convencionales de pronóstico incluyen el sitio del tumor primario y la histología del tumor. Para ayudar a determinar el tratamiento, también se utilizan variables de pronóstico biológico.
Factores biológicos
Se ha estudiado un gran número de variables biológicas en los niños que tienen este tumor. Las decisiones sobre el tratamiento se basan en factores de importancia como la clasificación de Shimada, el número de cromosoma en la célula tumoral, la amplificación del oncogén MYCN con tejido tumoral, un desbalance en la pérdida de heterozigocidad del 11q y la pérdida de heterozigocidad en el cromosoma 1p. Por lo general se necesita una biopsia abierta para obtener una cantidad adecuada de tejido para la determinación de estas características biológicas.
En la actualidad, no se utilizan muchas de las características biológicas de los tumores al momento de determinar la terapia; sin embargo, en la medida en que la investigación clínica madura, estas características pueden resultar útiles como objetivos terapéuticos o como factores pronósticos importantes. La amplificación del MYCN está relacionada con la eliminación del cromosoma 1p y la ganancia del brazo largo del cromosoma 17 (17q); éste último, independientemente, indica un pronóstico desfavorable. En contraste, la amplificación del gen MYCN, el grado de expresión del gen MYCN en el tumor, no predice el pronóstico.
Otros factores biológicos pronósticos que han sido investigados de manera intensiva, incluye la longitud del telomero, actividad de la telomerasa en la célula tumoral y ARN; el ácido urinario vanillilmandélico, [[ácido homovanillico y su proporción; dopamina; expresión CD44; expresión genética TrkA; concentraciones de enolasa específicas a las neuronas, concentraciones de dehidrogenasa láctica, concentraciones del suero ferritín. Una expresión de alto nivel del gen de resistencia farmacológica MRP1 es un indicador independiente de una disminución en la supervivencia. El perfil de los receptores GABAergic expresados en el neuroblastoma es un valor pronóstico independientemente de la edad, estadio y amplificación MYCN. El perfil de la expresión genética podría resultar útil en la predicción del pronóstico. Además, la respuesta al tratamiento se ha relacionado con los resultados. La persistencia de las células de neuroblastoma en la médula ósea, durante o después de la quimioterapia, por ejemplo, están relacionadas con un pronóstico precario.
Estadificación del Neuroblastoma
El INNS combina ciertas características de los sistemas POG y CCG que se empleaban anteriormente y ha identificado a grupos con pronósticos definidos.
- Estadio 1 : Tumor localizado con escisión macroscópica completa, con enfermedad residual microscópica o sin esta; ganglios linfáticos ipsilaterales representativos, microscópicamente negativos para el tumor (como los nódulos adheridos al tumor primario y extirpados junto con éste, pueden ser positivos).
- Estadio 2A : Tumor localizado con escisión macroscópica incompleta; ganglios linfáticos ipsilaterales representativos, negativos para el tumor microscópicamente.
- Estadio 2B : Tumor localizado con escisión macroscópica completa o sin esta; ganglios linfáticos ipsilaterales no adherentes, positivos para el tumor. Los ganglios linfáticos contralaterales agrandados deben ser negativos microscópicamente.
- Estadio 3 : Tumor irresecable unilateral, infiltrante más allá de la línea media, con afectación de los ganglios linfáticos regionales o sin esta; o tumor unilateral localizado con compromiso de los ganglios linfáticos regionales contralaterales; o tumor en la línea media con extensión bilateral por infiltración (irresecable) o por afectación del ganglio linfático. La línea media está determinada por la columna vertebral. Los tumores que se originan en un lado y cruzan la línea media deben infiltrase sobre esta, o hacia el lado opuesto de la columna vertebral.
- Estadio 4 : Todo tumor primario con diseminación a ganglios linfáticos distantes, huesos, la médula ósea, hígado, piel u otros órganos, con excepción de lo definido para el estadio 4S.
- Estadio 4S : Tumor primario localizado, como se define para el estadio 1, 2A o 2B, con diseminación limitada a la piel, el hígado o la médula ósea (como el circunscrito a lactantes menores de un año de edad). La afectación medular debe ser mínima (o sea, <10% de células nucleadas totales identificadas como malignas por biopsia de hueso o por aspirado de médula ósea). Una afectación más extensa de la médula ósea se consideraría como enfermedad en estadio IV. Los resultados de la gammagrafía con MBIG (metaiodobenzilguanidina) en caso de que se efectúe, deben ser negativos para la enfermedad en la médula ósea.
Opciones de tratamiento
Este plan de tratamiento del neuroblastoma basado en el riesgo asigna a todos los pacientes a un grupo de riesgo bajo, intermedio o alto. En los pacientes sin enfermedad metastásica, se practica la cirugía inicial para establecer el diagnóstico, resecar tanto tumor primario como sea posible, estadificar en forma precisa la enfermedad por medio de muestras de los ganglios linfáticos regionales que no están adheridos al tumor y para obtener una cantidad adecuada de tejido para estudios biológicos.
Bajo riesgo
El tratamiento para pacientes clasificados como de bajo riesgo consiste en cirugía exclusivamente, pero en algunos casos podría ser cirugía combinada con 6 a 12 semanas de quimioterapia. La quimioterapia se reserva para aquellos pacientes sintomáticos, como aquellos con compresión a la médula espinal o en estadio 4S, compromiso respiratorio secundario a la infiltración hepática. La quimioterapia consiste de carboplatino, ciclofosfamida, doxorubicina y etopósido. La dosis acumulativa de cada fármaco se mantiene baja para minimizar una lesión permanente a causa del régimen quimioterapéutico.
Riesgo intermedio
Los pacientes clasificados como de riesgo intermedio se tratan con cirugía y 12 a 24 semanas del mismo régimen descrito anteriormente.
Alto riesgo
Los pacientes clasificados como de alto riesgo se tratan por lo general con quimioterapia combinada intensiva, que consiste en dosis muy altas de los medicamentos mencionados anteriormente, pero a menudo incluye también ifosfamida y dosis altas de cisplatino. Después de que se obtiene respuesta a la quimioterapia, se obtiene intentar la resección del tumor primario, seguida por quimioterapia mieloablativa, en ocasiones irradiación de todo el organismo y con trasplante de células madre autólogas. Con frecuencia se lleva a cabo radiación del tumor residual y el sitio original de la metástasis antes durante o después de la terapia mieloablativa. Después de la recuperación, los pacientes se tratan con ácido 13-cis -retinoico oral, durante 6 meses. Tanto la terapia mieloablativa como el ácido retinoico mejoran el resultado en pacientes clasificados como de alto riesgo.
Radiación
La radioterapia se reserva para pacientes con tumor sintomático que amenaza la vida o los órganos afectados, el cual no responde suficientemente rápido a la quimioterapia, o para pacientes con riesgo intermedio cuyo tumor ha respondido en forma incompleta tanto a la quimioterapia como al intento de resección y presenta también características biológicas desfavorables. Se recomienda con frecuencia la radioterapia en el sitio primario para pacientes de alto riesgo incluso en casos de resección completa.
Pronóstico
Los resultados esperados varían. En los niños muy pequeños con neuroblastoma, el tumor puede resolverse de manera espontánea, sin tratamiento o los tejidos del tumor pueden madurar y desarrollarse para formar un ganglioneuroma benigno, que puede extirparse quirúrgicamente. En otros casos, el tumor se disemina con rapidez.
La respuesta al tratamiento es variable, aunque tiende a ser bastante exitosa si el tratamiento se inicia antes de la diseminación del tumor; de lo contrario, si se ha diseminado a otras áreas, el neuroblastoma es mucho más difícil de curar.
Complicaciones
- Diseminación (metástasis) del tumor
- Daño o pérdida de la función del órgano u órganos involucrados insuficiencia renal Insuficiencia hepática pérdida de las células sanguíneas producidas por la médula ósea disminución de la resistencia a infecciones otras insuficiencias de sistemas de órganos
Situaciones que requieren asistencia médica
Se debe buscar asistencia médica si hay síntomas que puedan indicar la presencia de un neuroblastoma. El diagnóstico y tratamiento tempranos mejoran las probabilidades de un buen resultado.
Bibliografía
1 - Sanders J, Glader B, Cairo M, et al.: Guidelines for the pediatric cancer center and role of such centers in diagnosis and treatment. American Academy of Pediatrics Section Statement Section on Hematology/Oncology. Pediatrics 99(1): 139-141, 1997.
2 - Jennings RW, LaQuaglia MP, Leong K, et al.: Fetal neuroblastoma: prenatal diagnosis and natural history. Journal of Pediatric Surgery 28(9): 1168-1174, 1993.
3 - Hiyama E, Yokoyama T, Hiyama K, et al.: Multifocal neuroblastoma. Biologic behavior and surgical aspects. Cancer 88(8): 1955-1963, 2000.
4 - Azizkhan RG, Haase GM: Current biologic and therapeutic implications in the surgery of neuroblastoma. Seminars in Surgical Oncology 9(6): 493-501, 1993.
5 - Connolly AM, Pestronk A, Mehta S, et al.: Serum autoantibodies in children opsoclonus-myoclonus syndrome: an analysis of antigenic targets in neural tissues. Journal of Pediatrics 130(6): 878-884, 1997.
6 - Rudnick E, Khakoo Y, Antunes NL, et al.: Opsoclonus-myoclonus-ataxia syndrome in neuroblastoma: clinical outcome and antineuronal antibodies--a report from the Children's Cancer Group study. Medical and Pediatric Oncology 36(6): 612-622, 2001.
7 - Cooper R, Khakoo Y, Matthay KK, et al.: Opsoclonus-myoclonus-ataxia syndrome in neuroblastoma: histopathologic features--a report from the Children's Cancer Group. Medical and Pediatric Oncology 36(6): 623-629, 2001.
8 - Pranzatelli MR: The neurobiology of the opsoclonus-myoclonus syndrome. Clinical Neuropharmacology 15(3): 186-228, 1992.
9 - Mitchell WG, Davalos-Gonzalez Y, Brumm VL, et al.: Opsoclonus-ataxia caused by childhood neuroblastoma: developmental and neurologic sequelae. Pediatrics 109(1): 86-98, 2002.
10 - Russo C, Cohn SL, Petruzzi MJ, et al.: Long-term neurologic outcome in children with opsoclonus-myoclonus associated with neuroblastoma: a report from the Pediatric Oncology Group. Medical and Pediatric Oncology 28(4): 284-288, 1997.
11 - Brodeur GM, Pritchard J, Berthold F, et al.: Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment. Journal of Clinical Oncology 11(8): 1466-1477, 1993.
12 - Adams, GA, Shochat SJ, Smith EI, et al.: Thoracic neuroblastoma: a Pediatric Oncology Group study. Journal of Pediatric Surgery 28(3): 372-378, 1993.
13 - Evans AE, Albo V, D'Angio GJ, et al.: Factors influencing survival of children with nonmetastatic neuroblastoma. Cancer 38(2): 661-666, 1976.
14 - Hayes FA, Green A, Hustu HO, et al.: Surgicopathologic staging of neuroblastoma: prognostic significance of regional lymph node metastases. Journal of Pediatrics 102(1): 59-62, 1983.
15 - Cotterill SJ, Pearson AD, Pritchard J, et al.: Clinical prognostic factors in 1277 patients with neuroblastoma: results of the European Neuroblastoma Study Group 'Survey' 1982-1992. European Journal of Cancer 36(7): 901-908, 2000.
16 - Brodeur GM, Azar C, Brother M, et al.: Neuroblastoma: effect of genetic factors on prognosis and treatment. Cancer 70(6, Suppl): 1685-1694, 1992.
17 - Bowman LC, Hancock ML, Santana VM, et al.: Impact of intensified therapy on clinical outcome in infants and children with neuroblastoma: the St Jude Children's Research Hospital experience, 1962-1988. Journal of Clinical Oncology 9(9): 1599-1608, 1991.
18 - McWilliams NB, Hayes FA, Green AA, et al.: Cyclophosphamide/doxorubicin vs. cisplatin/teniposide in the treatment of children older than 12 months of age with disseminated neuroblastoma: a Pediatric Oncology Group randomized phase II study. Medical and Pediatric Oncology 24(3): 176-180, 1995.
19 - Franks LM, Bollen A, Seeger RC, et al.: Neuroblastoma in adults and adolescents: an indolent course with poor survival. Cancer 79(10): 2028-2035, 1997.
20 - Look AT, Hayes FA, Shuster JJ, et al.: Clinical relevance of tumor cell ploidy and N-myc gene amplification in childhood neuroblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 9(4): 581-591, 1991.
21 - Schmidt ML, Lukens JN, Seeger RC, et al.: Biologic factors determine prognosis in infants with stage IV neuroblastoma: a prospective Children's Cancer Group study. Journal of Clinical Oncology 18(6): 1260-1268, 2000.
22 - Berthold F, Trechow R, Utsch S, et al.: Prognostic factors in metastatic neuroblastoma: a multivariate analysis of 182 cases. American Journal of Pediatric Hematology/Oncology 14(3): 207-215, 1992.
23 - Matthay KK, Perez C, Seeger RC, et al: Successful treatment of stage III neuroblastoma based on prospective biologic staging: a Children's Cancer Group study. Journal of Clinical Oncology 16(4): 1256-1264, 1998.
24 - Ladenstein R, Ambros IM, Potschger U, et al.: Prognostic significance of DNA di-tetraploidy in neuroblastoma. Medical and Pediatric Oncology 36(1): 83-92, 2001.
25 - Tonini GP, Boni L, Pession A, et al.: MYCN oncogene amplification in neuroblastoma is associated with worse prognosis, except in stage 4s: the Italian experience with 295 children. Journal of Clinical Oncology 15(1): 85-93, 1997.
26 - Maris JM, Weiss MJ, Guo C, et al.: Loss of heterozygosity at 1p36 independently predicts for disease progression but not decreased overall survival probability in neuroblastoma patients: a Children's Cancer Group study. Journal of Clinical Oncology 18(9): 1888-1899, 2000.
27 - Cohn SL, London WB, Huang D, et al.: MYCN expression is not prognostic of adverse outcome in advanced-stage neuroblastoma with nonamplified MYCN. Journal of Clinical Oncology 18(21): 3604-3613, 2000.
28 - Bown N, Lastowska M, Cotterill S, et al.: 17q gain in neuroblastoma predicts adverse clinical outcome. Medical and Pediatric Oncology 36(1): 14-19, 2001.
29 - Bown N, Cotterill S, Lastowska M, et al.: Gain of chromosome arm 17q and adverse outcome in patients with neuroblastoma. New England Journal of Medicine 340(25): 1954-1961, 1999.
30 - Nakagawara A, Arima-Nakagawara M, Scavarda NJ, et al.: Association between high levels of expression of the TRK gene and favorable outcome in human neuroblastoma. New England Journal of Medicine 328(12): 847-854, 1993.
31 - Poremba C, Hero B, Goertz HG, et al.: Traditional and emerging molecular markers in neuroblastoma prognosis: the good, the bad and the ugly. Klinische Padiatrie 213(4): 186-190, 2001.
32 - Hann HW, Evans AE, Siegel SE, et al.: Prognostic importance of serum ferritin in patients with stages III and IV neuroblastoma: the Childrens Cancer Study Group experience. Cancer Research 45(6): 2843-2848, 1985.
33 - Shuster JJ, McWilliams NB, Castleberry R, et al.: Serum lactate dehydrogenase in childhood neuroblastoma: a Pediatric Oncology Group recursive partitioning study. American Journal of Clinical Oncology 15(4): 295-303, 1992.
34 - Massaron S, Seregni E, Luksch R, et al.: Neuron-specific enolase evaluation in patients with neuroblastoma. Tumour Biology 19(4): 261-268, 1998.
35 - De Bernardi B, Pianca C, Boni L, et al.: Disseminated neuroblastoma (stage IV and IV-S) in the first year of life: outcome related to age and stage. Italian Cooperative Group on Neuroblastoma. Cancer 70(6): 1625-1633, 1992.
36 - Combaret V, Gross N, Lasset C, et al.: Clinical relevance of CD44 cell-surface expression and N-myc gene amplification in a multicentric analysis of 121 pediatric neuroblastomas. Journal of Clinical Oncology 14(1): 25-34, 1996.
37 - Reynolds CP, Seeger RC: Detection of minimal residual disease in bone marrow during or after therapy as a prognostic marker for high-risk neuroblastoma. Journal of Pediatric Hematology/Oncology 23(3): 150-152, 2001.
38 - Burchill SA, Lewis IJ, Abrams KR, et al.: Circulating neuroblastoma cells detected by reverse transcriptase polymerase chain reaction for tyrosine hydroxylase mRNA are an independent poor prognostic indicator in stage 4 neuroblastoma in children over 1 year. Journal of Clinical Oncology 19(6): 1795-1801, 2001.
39 - Seeger RC, Reynolds CP, Gallego R, et al.: Quantitative tumor cell content of bone marrow and blood as a predictor of outcome in stage IV neuroblastoma: a Children's Cancer Group study. Journal of Clinical Oncology 18(24): 4067-4076, 2000.
40 - Sawada T: Past and future of neuroblastoma screening in Japan. American Journal of Pediatric Hematology/Oncology 14(4): 320-326, 1992.
41 - Murphy SB, Cohn SL, Craft AW, et al.: Do children benefit from mass screening for neuroblastoma? Consensus statement from the American Cancer Society workshop on neuroblastoma screening. Lancet 337(8737): 344-346, 1991.
42 - Woods WG, Lemieux B, Leclerc JM, et al.: Screening for neuroblastoma (NB) in North America: the Quebec Project. In: Evans AE, Biedler JL, Brodeur GM, et al., eds.: Advances in Neuroblastoma Research 4. Wiley-Liss, Inc, 1994, pp 377-382.
43 - Takeuchi LA, Hachitanda Y, Woods WG, et al.: Screening for neuroblastoma in North America. Preliminary results of a pathology review from the Quebec Project. Cancer 76(11): 2363-2371, 1995.
44 - Woods WG, Tuchman M, Robison LL, et al.: A population-based study of the usefulness of screening for neuroblastoma. Lancet 348(9043): 1682-[[1687], 1996.
45 - Nishihira H, Toyoda Y, Tanaka Y, et al.: Natural course of neuroblastoma detected by mass screening: a 5-year prospective study at a single institution 18(16): 3012-3017, 2000.