Pentóxido de Dinitrógeno
Sumario
Propiedades físicas
El pentóxido de dinitrógeno, de masa molar 108,01 g/mol, es un compuesto sólido de color blanco, funde a 30,0°C, es estable a temperaturas inferiores a los 8°C, y además debe estar en ausencia de luz solar. En estado de elevada pureza, forma cristales duros, incoloros delicuescentes al aire.
Puede describirse como anhidrido de ácido- es el óxido obtenido eliminando agua de un oxoácido-
Estructura
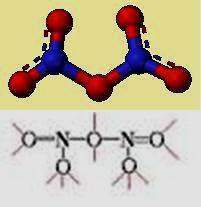
Su estructura se forma por eliminación de agua del ácido nítrico, constituye un interesante ejemplo de una sustancia cuya unidad estructural molecular es diferente en estado sólido y en fase gaseosa
En fase gaseosa está constituido por moléculas covalentes, por el contrario los estudios ópticos y con rayos X muestran que el sólido blanco es un compuesto iónico integrado por iones nitronio(NO2) + e iones nitrato(NO3) - . La experimentación indica que el N2 O5 debe ser el compuesto iónico "nitrato de nitronio", (NO2) + (NO3) - . El ion nitronio es isoelectrónico con el dióxido de carbono y el dióxido de dinitrógeno,tiene una estructura AX2 lineal (O-N-O). El ion nitrato es isoelectrónico con el monóxido de carbono y el fluoruro de boro y tiene la estructura trigonal plana; pero su elevada volatilidad demuestra que el cristal iónico, pasa fácilmente a moléculas covalentes al estado gaseoso.
Obtención
Se obtiene por deshidratación del ácido nítrico al 100% con pentóxido de difósforo (P4 O10)
, o bien por acción del dicloro sobre el nitrato de plata a 60°C
Fuente natural de obtención
Es generado en el aire en una concentración muy baja, a menos que sea emitido por algún proceso (tal como una instalación productora de ácido nítrico) que esté diseñada específicamente para generarlo.
Propiedades químicas
El pentóxido de dinitrógeno es altamente reactivo, y forma ácido nítrico (HNO3) cuando se descompone en el agua.
es la forma más altamente ionizada de óxido de nitrógeno, lo que le infiere una gran capacidad de combustión.
Se descompone lentamente a temperatura ambiente para obtener dióxido de nitrógeno y diOxígeno
Mecanismo de descomposición
El mecanismo de descomposición del pentóxido de dinitrógeno implica al trióxido de nitrógeno transitorio(NO3). En el primer paso de la descomposición el N2 O5 está en equilibrio con el dióxido de nitrógeno (NO2) y trióxido de nitrógeno (NO3)
Algunas colisiones entre el NO2 y trióxido de nitrógeno NO3, conducen a la formación de una molécula de diOxígeno( O2):>)
Una representación más detallada de este paso es
Imagen: Mecanismo_de_descomposición.jpg
De este modo, la molécula NO2 del producto contiene un átomo de Nitrógeno diferente al de la molécula de NO2 del reaccionante. Finalmente, el NO reacciona rápidamente con NO3
Asi la descomposición del pentóxido de dinitrógeno puro, tanto el NO3 como el NO son intermediarios reactivos y están presentes solo en concentraciones muy bajas.
Utilización
Conocido también como anhídrido nitroso, que es un agente nitrante excelente, y se utiliza para la síntesis de la mayoría de los materiales energéticos, que se obtienen por la nitración de una variedad de sustratos tales como compuestos aromáticos, alcanos, alquenos, alcoholes, azúcares , oximas, aminas y amidas.
Referencias
- Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
- Mahan, B.H: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1975.
Fuentes
Enlace externo