Priones
| ||||||
Los priones son partículas no celulares; son proteínas que sin ser virus, tienen también características patógenas e infecciosas. Los priones no son organismos vivos, son solo proteínas sin ácido nucleico.
Sumario
¿Qué es un prión?
El término “prión” se deriva de partícula infecciosa proteinacious, es una proteína mal plegada capaz de transmitir su forma mal plegada a otras variedades de la misma proteína. y se refiere al patógeno que causa la Encefalopatía espongiforme transmisible (TSEs), que son un grupo de enfermedades neurológicas degenerativas tales como la tembladera, la enfermedad de Creutzfeldt-Jakob y la encefalopatía espongiforme bovina. Los priones son considerados agentes infecciosos y su forma intracelular puede no contener ácido nucleico.
Los priones no son virus ni bacterias pero infectan y producen enfermedades letales. Estas proteínas provocan todo tipo de efectos debido su naturaleza sencilla. Y ni siquiera distinguen entre especies.
Esta pequeña partícula infecciosa es llamada proteína celular del prión (PrPc). PrPc se encuentra principalmente en la superficie de células en el sistema nervioso central, pero también está situada en otros tejidos corporales. En comparación con los otros agentes infecciosos existentes que son autónomos de su huésped, los priones se originan de la mala síntesis proteica del gen PRNP. Sin embargo, se desconoce por qué se pueden transmitir entre individuos, ya que las enfermedades causadas por priones podrían considerarse un tipo de enfermedad genética. Aunque el papel específico de PrPc no esté definido, hay estudios que sugieren que esta proteína desempeña un papel protector en células y les ayude para responder a la deficiencia del oxígeno.
Un prión se compone de la proteína anormalmente plegada que causa condiciones neurodegenerativas progresivas, estas proteínas mal plegadas no se multiplican en el organismo del organismo principal que infectan, en lugar de eso, afectan a la estructura del cerebro actuando como modelo, induciendo a las proteínas con el plegamiento normal a que se conviertan al modelo anormal del prión.
Tienen la capacidad de infectar a un ser vivo, cambiar sus proteínas y hacerlo enfermar lentamente. No es un parásito, ni un microorganismo ni tan siquiera un virus.
Es más pequeño y sencillo. Pero sus efectos en los animales puede provocar que el cerebro se puede esperar, son fatales para quienes sufren su ataque. Y los más inquietante es que no obedecen a ninguna razón especial. Los priones son así, sencillamente. Cuando infectan, cambian las proteínas a su paso sin "conseguir" nada a cambio. Pero son proteínas "rotas", mal dobladas.
La configuración de estas proteínas provoca cambios en sus proteínas similares, rompiéndolas a su vez. Pero los priones, al contrario que los virus y las bacterias, no tienen ni ADN ni ningún tipo de maquinaria específica para reproducirse. ¡Son mucho más pequeñas que eso! En realidad son las piezas que conforman cualquier estructura biológica. Están compuestos, por lo tanto, sólo de aminoácidos, formando la proteína. Y las proteínas son la base de la vida.
Función de los priones en estado no patógeno (PrPc)
A pesar de que actualmente hay muy poca información sobre la función que tiene la proteína PrPc (estado no patógeno), algunos experimentos han demostrado que tienen un papel activo en el correcto desarrollo neuronal, que es una proteína capaz de unir específicamente Cu2+ (procesos rédox), y también se han relacionado los priones con proteínas de transducción de señales, la adhesión celular y la regulación y distribución de los receptores de acetilcolina.
Descubrimiento del Prión
En 1960, investigaciones mostraron que el agente que causa la EET de las ovejas o la enfermedad por virus lento era altamente resistente a ser desactivado por los rayos ultravioletas y la radiación ionizante, las terapias que destruirían generalmente cualquier patógeno que contuviera el ácido nucleico. Sin embargo, la naturaleza de estas partículas era todavía no entendible y los científicos hicieron diversas sugerencias incluyendo las proteínas, los fragmentos de la membrana, los pequeños virus de DNA y los polisacáridos.
Algunos investigadores plantearon que cualquiera que fuera la naturaleza del agente, no dependía del ácido nucleico para reproducirse. En 1982, Stanley B. Prusiner de la Universidad de California en San Francisco, publicó un artículo en la “Ciencia” que demostraba la purificación de la enfermedad por virus lento que causaba el agente y lo describió como una proteína. Prusiner escribió en el artículo: “porque las propiedades nuevas del agente de la enfermedad por virus lento lo distinguen de virus, de plásmidos, y de viroides, “el prión” de un nuevo término fue propuesto para denotar una pequeña partícula infecciosa proteica que es resistente a la desactivación por la mayoría de los procedimientos que modifiquen los ácidos nucleicos.” El descubrimiento de Prusiner lo llevó a que le concedieran el Premio Nobel en 1997.
Características del Prión
Los Priones son tan pequeños que son incluso más pequeños que los virus y pueden ser vistos solamente a través de un microscopio electrónico cuando han agregado y han formado un atado. Los Priones son también únicos en que no contienen el ácido nucleico, a diferencia de las bacterias, de los hongos, de los virus y de otros patógenos.
Los Priones son por lo tanto resistentes a los procedimientos que destruyen patógenos analizando el ácido nucleico. Además, estas partículas son una versión anormal de una proteína normal que se cifra ya en el cuerpo, no accionan una inmunorespuesta del organismo, a diferencia de como lo hacen otros patógenos.
La proteína normal del prión probablemente se compone de las bobinas flexibles designadas hélices alfa, pero en el formulario anormalmente plegable, estas hélices se estiran fuera en las estructuras denso pila de discos llamadas las hojas beta.
Las enzimas celulares designadas, las proteasas pueden analizar la proteína normal, pero las proteínas del prión son resistentes a esto y se acumulan posteriormente en el tejido cerebral donde se repliegan.
Comportamiento del Prión
Como puede también ser visto en algunos tipos de hongos, los priones fungicidas se han estudiado extensivamente para proporcionar pistas en cuanto a cómo los priones afectan a mamíferos, aunque los priones fungicidas no sean dañinos a su organismo principal.
Síntomas
Esto lleva al daño cerebral y a los síntomas de la enfermedad del prión, que incluyen la función empeorada del cerebro; cambios de la personalidad, memoria y comportamiento; anormalidades intelectuales basados en la disminución de las mismas y anormalidades de movimiento, ejemplo de ello la ataxia. Estos síntomas predominan durante la edad adulta y empeoran generalmente en un cierto plazo, eventual causando muerte dentro de varios años o aún de algunos meses.
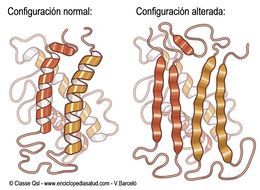
Diferencias entre la configuración normal y la configuración alterada de la proteína PrP
La configuración alterada que da lugar a la enfermedad priónica se caracteriza en que:
- Tiene un alto contenido de hoja-beta.
- Es insoluble frente a los detergentes.
- Es resistente a la proteolisis o degradación de la proteína mediante enzimas.
- Se localiza mayoritariamente en el espacio extracelular.
- Tiene tendencia a agregarse.
Enfermedades por priones
Las enfermedades por priones esporádicas son las más frecuentes de todas las enfermedades por priones humanas y representan del 85 al 90% de todos los casos. La enfermedad de Creutzfeldt-Jakob esporádica es la más frecuente de los tipos más común entre las enfermedades por priones esporádicas. Se produce aproximadamente un caso de enfermedad de Creutzfeldt-Jakob esporádica por cada millón de personas cada año en todo el mundo.
Hay tres tipos de enfermedad por priones esporádica:
- Insomnio mortal.
- Prionopatía variable sensible a proteasas.
Las enfermedades por priones genéticas (denominadas enfermedades por priones familiares) implican una mutación en el gen de la PrPC, que puede ser hereditaria. La mutación hace que las PrPC sean más propensas a convertirse en priones. Existen muchos tipos de mutaciones. Por lo general, cada mutación causa una enfermedad por priones diferente.
Existen tres grupos principales de enfermedades por priones familiares:
- Enfermedad de Creutzfeldt-Jakob familiar .
- Insomnio familiar mortal.
- Enfermedad de Gerstmann-Sträussler-Scheinker
Las enfermedades por priones también pueden adquirirse por contagio, aunque estos casos son muy poco frecuentes. Se pueden adquirir:
- Si se come carne de ternera infectada por priones, como en la variante de la enfermedad de Creutzfeldt-Jakob también conocida como la versión humana de la «Enfermedad de las vacas locas».
- Si se trasplanta un órgano o tejido contaminado con priones.
- Si se administra un fármaco por vía intravenosa contaminado con priones.
- Si se realiza una cirugía cerebral con instrumentos contaminados con priones.
- Si se recibe una transfusión de sangre contaminada con priones (poco frecuente).
- El kuru también es una enfermedad por priones adquirida, más concida como Enfermedad de la risa, que aparecía entre los nativos de Papúa Nueva Guinea.
No existe curación para las enfermedades por priones, y todas sus variantes son mortales, en general entre unos meses y pocos años después de la aparición de los síntomas. El único tratamiento disponible está orientado a mantener confortable a la persona y a tratar los síntomas. Algunas estrategias pueden ayudar a los cuidadores de los afectados con una enfermedad por priones a enfrentarse a la demencia causada por la enfermedad.
Si es posible, los afectados por una enfermedad por priones deben redactar, antes de que queden incapacitadas, el documento de voluntades anticipadas para detallar el tipo de atención médica deseada en los momentos finales. Los familiares de afectados por la forma hereditaria de la enfermedad por priones deben procurarse consejo genético.