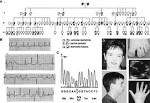
Síndrome de Andersen-Tawil
| ||||
El síndrome de QT largo (SQTL) es una canalopatía que genera grave alteración en la repolarización ventricular predispone a arritmias malignas y muerte súbita. Fue la primera canalopatía arritmogénica descrita y quizá la mejor entendida hasta ahora.
Transcurrida ya más de una década de la identificación de la primera mutación asociada al SQTL, se ha hecho evidente que este trastorno es mucho más frecuente de lo que inicialmente se pensaba; los avances en el conocimiento de la fisiopatología molecular de esta enfermedad han permitido hacer una correlación genotipo–fenotipo, optimizando el tratamiento y permitiendo estratificar el riesgo en forma precisa.
Se ha logrado entender con mayor detalle los efectos adversos de distintas drogas que interactúan con los canales iónicos, permitiendo así generar fármacos más seguros y, en su defecto, monitorizar de cerca aquellos que a pesar de tener este efecto adverso, es necesaria su administración. Los avances son importantes pero no todo está dicho, 25% de los casos no tienen mutaciones en los genes descritos hasta la fecha, por lo que el SQTL continúa siendo motivo de investigación.
El presente artículo constituye un resumen de los principales conceptos desarrollados en los últimos diez años que han sido cruciales en el manejo de esta enfermedad.
Sumario
Introducción
El síndrome de Andersen-Tawil(también conocido como síndrome de Andersen) es una canalopatía multisistémica, con un patrón de herencia autosómico dominante, con marcada variabilidad intrafamiliar y penetrancia incompleta. Se caracteriza por parálisis periódicas, arritmias ventriculares y rasgos dismórficos faciales y/o esqueléticos distintivos (micrognatia, anomalías dentales, ojos separados, clinodactilia, baja estatura, escoliosis.
También se han reportado casos de hipoplasia renal y enfermedad cardíaca valvular.
Existen dos tipos en función de la cuasa genética que conduce al desarrollo de la enfermedad. El síndrome de Andersen-Tawil tipo I representa alrededor de dos tercios de los casos y está causado por mutaciones en el gen KCNJ2. El tercio restante se ha designado como Tipo 2 y las causas que dan lugar a él son desconocidas todavía.
El gen KCNJ2 se encuentra localizado en el brazo largo del cromosoma 17 (17q24.3) y codifica para una proteína, Kir2.1, que forma un canal iónico a través de las membranas celulares. Este canal transporta iones de potasio a las células musculares, lo que resulta fundamental para el mantenimiento de las funciones normales de los músculos esquléticos y para el músculo cardíaco. Las mutaciones en el gen KCNJ2 alteran la estructura y con ello la función habitual de los canales de potasio.
Así, evitan que una molécula, denominada PIP2 (fosfatidilinositol 4,5-difosfato), cuya función es unirse a los canales y regular su actividad, pueda ensamblarse. De esta forma, el flujo de iones potasio al músculo esquelético y cardíaco se ve interrumpido o seriamente afectado, lo que lleva a pariálisis periódicas y a las irregulares características del ritmo cardíaco propias del síndrome de Andersen-Tawil.
Clínica
El síndrome de Andersen-Tawil afecta al corazón, los síntomas son debidos a alteraciones del ritmo cardíaco (arritmia ventricular) asociados a los síntomas del síndrome de QT largo. Hay algunas alteraciones físicas, afectando a cabeza, cara y miembros.Estas características frecuentemente incluyen una inusual mandíbula pequeña (micrognatia), implantación baja de orejas, a una curvatura anormal de los dedos llamada clinodactilia.
Pruebas realizadas en IVAMI
en IVAMI detectamos mutaciones en el gen KCNJ2, asociadas al síndrome de Andersen-Tawil, mediante la amplificación por PCR de los dos exones de este gen y la posterior secuenciación de los amplificados.
Muestras recomendadas
Sangre extraída con EDTA para la separación de leucocitos sanguíneos.
Clasificacaión del sindrome de QT Largo
La clasificación utilizada en la actualidad se fundamenta en el diagnóstico genético. Tenemos así los siguientes subtipos.
Síndrome de QT largo tipo 1 (SQTL1)
Es el subtipo más frecuente (30–35% de los casos). El gen afectado es el KvLQT1(o KCNQ1) localizado en el cromosoma 11 (11p15.5), el cual codifica la subunidad a del I de canal de potasio. Estos pacientes suelen presentar episodios de taquicardia helicoidal al realizar ejercicio o al estimular el simpático (62%).La penetrancia en este subtipo es cercana a 60.4%, por lo que con frecuencia se observan portadores de la mutación con intervalo QTc dentro de límites normales. El potencial de acción se prolonga por una disminución de la corriente saliente de K+ durante fase 3.
Síndrome de QT largo tipo 2 (SQTL2)
El gen afectado es el KCNH2 o HERG localizado en el cromosoma 7 (7q35–36), el cual codifica la subunidad a del canal de potasio r (25–30% de los casos). En estos pacientes las arritmias se presentan con mayor frecuencia en respuesta a estrés emocional o estímulos auditivos súbitos –p.e. reloj despertador– (43%) y con menos frecuencia al ejercicio (13%). La penetrancia estimada es de 79.1%. Al igual que en el SQTL1, la disfunción de este canal, disminuye la corriente saliente de K+ durante la fase 3 del potencial de acción, prolongando así su duración.
Síndrome de QT largo tipo 3 (SQTL3)
El gen afectado es el SCN5A, que codifica para canal de sodio Nav1.5, localizado en el cromosoma 3 (3p21–24); es causante de la enfermedad en 5–10% de los casos. La inactivación defectuosa del canal, permite la entrada sostenida de Na+, durante la fase 2 del potencial de acción. Estos pacientes tienen un riesgo mayor de presentar arritmias malignas durante el reposo (sueño) o bradicardia. La penetrancia de las mutaciones en este gen es cercana a 90%. Las mutaciones homocigotas en los subtipos SQTL1 y SQTL5 generan el síndrome de Jervell–Lange–Nielsen que cursa con sordera congénita y alto riesgo de muerte súbita. Afección a otros órganos.
Síndrome de QT largo tipo 4 (SQTL4)
Es una variedad de SQTL extremadamente rara, el gen afectado es el ANKB, localizado en el cromosoma 4 (4q25–27), el cual codifica la síntesis de anquirina–β, perteneciente a una familia de proteínas estructurales de distribución ubicua, que vinculan proteínas membranales integrales con proteínas del citoesqueleto, entre otras, la bomba Na/K ATPasa, intercambiador Na/Ca y H/K ATPasa.
Las mutaciones que causan pérdida de la función de anquirina–β, resultan en un incremento en la concentración de calcio intracelular, así como alteración en la expresión de N/K ATPasa e intercambiador Na/Ca; la conductancia a otros iones es afectada, favoreciendo no sólo la prolongación del intervalo QT, sino generando también despolarizaciones espontáneas. Se asocia con frecuencia a disfunción del nodo sinusal y bradicardia.Explica menos de 1% de los casos.
Síndrome de QT largo tipo 5 (SQTL5)
Es condicionado por cambios de secuencia del gen KCNE1 33 localizado en el cromosoma 21 (21q22.1–p22), codifica la síntesis de la subunidad β del canal IKsconocida también como subunidad minK que regula al canal IKa. Explica menos de 1% de los casos.
Síndrome de QT largo tipo 6 (SQTL6)
El gen afectado es el KCNE2 localizado en el cromosoma 21 (21q22.1). Codifica la subunidad β del canal de potasio, conocida también como subunidad MiRPl que regula al canal I. Explica menos de 1% de los casos.
Mutaciones que asician SQTL y enfermedad sistémica
Síndrome de QT largo tipo 7 (SQTL7) Es causado por mutaciones en el gen KCNJ2 localizado en el cromosoma 17 (17q23) que codifica la síntesis del canal Kir 2.1; este canal participa en la fase 4 del potencial de acción. Su alteración da lugar al síndrome de Andersen, desorden autosómico dominante que se caracteriza por SQTL, parálisis periódica, desarrollo esquelético anormal, arritmias ventriculares del tipo de la extrasistolia ventricular frecuente con susceptibilidad particular a presentar fibrilación ventricular, sobre todo en el sexo femenino. Su expresividad es variable, lo que complica el diagnóstico oportuno de la enfermedad.Explica menos de 0.5% de los casos.
Síndrome de QT largo tipo 8 (SQTL8)
Descrito recientemente, resulta de mutaciones en el gen que codifica el canal de calcio tipo L Cav1.2. Ocasiona el síndrome de Timothy, caracterizado por malformaciones cardíacas, deficiencia inmunológica, hipoglucemia intermitente, trastornos cognitivos, incluso autismo; fusiones interdigitales y QT largo que predispone a arritmias cardíacas y muerte súbita. Explica menos de 0.5% de los casos.
MUTACIONES COMPUESTAS
Hasta en 8% de los casos con SQTL se pueden encontrar variantes en más de un gen. El intervalo QTc en estos casos suele ser muy prolongado, la incidencia de arritmias es alta con importante riesgo de muerte súbita.
Mutaciones de la variedad Jervell Lange–Nielsen
Corresponde a mutaciones homocigotas o heterocigotas compuestas en los genes KCNQ1 y/o KCNE1 que codifican la corriente Is. En forma característica, se asocia a sordera congénita; los pacientes suelen tener un QTc > 500 ms, síncope recurrente por taquicardia helicoidal y alto riesgo de muerte súbita. En el tipo homocigoto, los padres de los pacientes con esta variedad son heterocigotos para la misma mutación y manifiestan una enfermedad menos grave o incluso pueden ser asintomáticos.
De acuerdo con la clasificación anterior podemos concluir que los subtipos SQTL1, SQTL2 y SQTL3 son los más frecuentes y por lo tanto han sido mejor caracterizados clínicamente, con frecuencia nos referiremos a estas tres variantes exclusivamente.
Fuente
- Wever EF, Robles de Medina EO. Sudden death in patients without structural heart disease. J Am Coll Cardiol 2004; 43: 1137–44
- Zipes DP, Wellens HJ. Sudden cardiac death. Circulation 1998; 98: 2334–51*Chugh SS, Kelly KL, Titus JL. Sudden cardiac death with apparently normal heart. Circulation. 2000; 102: 649–54.
- Puranik R, Chow CK, Duflou JA, Kilborn MJ, McGuire MA. Sudden death in the young. Heart Rhythm. 2005; 2: 1277–82.
- Nerbonne JM, Kass RS. Molecular physiology of cardiac repolarization. Physiol Rev 2005; 85: 1205–53
- Herrlin KMMT. A case of cardiac syncope. Acta Paediatriva 1953; 391
- Curran ME, Splawski I, Timothy KW, Vincent GM, Green ED, Keating MT. A molecular basis for cardiac arrhythmia: HERG mutations cause long QT syndrome. Cell. 1995; 80: 795–803
- Wang Q, Shen J, Li Z, et al. Cardiac sodium channel mutations in patients with long QT syndrome, an inherited cardiac arrhythmia. Hum Mol Genet 1995; 4: 1603–7
- Beccaria E, Brim S, Gaita F, Giustetto C, Conti M. Torsade de pointes during an atropine sulfate test in a patient with congenital long QT syndrome. Cardiología 1989; 34: 1039–43.
- Jervell A, Lange–Nielsen F. Congenital deaf–mutism, functional heart disease with prolongation of the Q–T interval and sudden death. Am Heart J 1957; 54: 59–68.
- Romano C, Gemme G, Pongiglione R. Rare cardiac arrhythmias of the pediatric age. I. Repetitive Paroxysmal Tachycardia. Minerva Pediatr 1963; 15: 1155–64.
- Wang Q, Shen J, Splawski I, et al. SCN5A mutations associated with an inherited cardiac arrhythmia, long QT syndrome. Cell 1995; 80: 805–11.