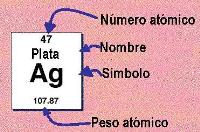
Esta forma de
Tabla periódica de Elementos Químicos es adoptada por la norma cubana y se utiliza actualmente para la enseñanza de la Química, este sistema periódico intenta destacar tanto las relaciones químicas como las electrónicas. Las líneas horizontales se denominan períodos, cada periodo corresponde a la formación de una nueva capa de electrones. Los elementos alineados tienen estructuras electrónicas estrictamente análogas. El principio y el final de un periodo largo representan la adición de electrones en una capa de valencia; en la parte central aumenta el número de electrones de una capa subyacente.
Características de la tabla periódica
La tabla periódica nos ayuda a comprender el comportamiento, las propiedades y la reactividad de los elementos.
Las propiedades de los elementos tienden a reproducirse de manera regular (periódica) al ordenar a los elementos según su número atómico.
información que brinda la tabla periódica
A cada elemento químico le corresponde un casillero, donde figuran el correspondiente nombre, símbolo, número atómico, la masa atómica(Peso atómico), y otros datos.
Elementos químicos conocidos en la actualidad
se conocen 148 elementos
elementos químicos
De ellos tenemos:
131 elementos metálicos
87 elementos son metales
26 elementos radioactivos
16 elementos han sido fabricados por el hombre (radioactivos todos)
2 elementos son líquidos
Los metales se encuentran a la izquierda de la tabla. El primer elemento de cada periodo (Li(Litio), Na(Sodio), K(Potasio), etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupo 17 son francamente no metales.
Algunas propiedades de los metales
En general, la mayoría de los metales tienen las propiedades siguientes:
- Son dúctiles y maleables.
- Presentan brillo (lustre)
- Son buenos conductores del calor
- Son buenos conductores de la electricidad
- Todos excepto el Hg son sólidos a temperatura ambiente
- Al hacer reaccionar su sustancia simple con la sustancia simple no metálica ceden electrones
11 son gases a presión y temperatura normales
6 son gases nobles monoatómicos
Observaciones generales
- Al hidrógeno no se lo ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo 1, pero sus propiedades se asemejan más al grupo 17.
- Una línea quebrada que pasa entre el boro (B) y el aluminio(Al) y desciende hasta el polonio(Po) y el astato(At) señala la separación entre metales y no metales. Esta separación no debe ser considerada como un limite absoluto entre metales y no metales: cerca de este límite arbitrario, hay elementos que presentan características tanto de los metales como de los no metales, y por ello a veces reciben el nombre de metaloides (Al(Aluminio), Si(Silicio), Ge(Germanio), As(Arsénico), etc.)
Algunas propiedades de los no metales
En general, pueden presentar todos los estados de agregación a temperatura y presión estandar ambiente (TPEA)
- El dicloro (Cl2) es un gas, el dibromo (Br2) es líquido, el diyodo(I2) es sólido
- Generalmente son malos conductores del calor.
- Generalmente son malos conductores de la electricidad.
- Muchos de ellos existen como moléculas diatómicas
- Las sustancias simples que forman al reaccionar con las sustancias simples metálicas captan electrones
- Las sustancias simples que forman al reaccionar con sustancias simples no-metálicos comparten electrones.
Períodos
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno(H) y helio(He); ambos tienen sólo el orbital 1s -H 1s1, He 1s2- , y los dos periodos siguientes(2 y 3), cada uno con ocho elementos, se llaman periodos cortos. Los periodos restantes, llamados periodos largos, contienen 18 elementos en el caso de los periodos 4 y 5, o 32 elementos en el del periodo 6. El periodo largo 7 incluye el grupo de los actínidos, que ha sido completado sintetizando núcleos radiactivos más allá del elemento 92, el uranio.
El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto.
La tabla periódica consta de 7 períodos:
Período 1
tiene sólo dos elementos químicos.
Período 2 y Período 3
Tienen ocho elementos químicos.
Período 4 y Período 5
Tienen dieciocho elementos químicos.
Período 6
Tiene treinta y dos elementos químicos.
Período 7
No tiene los treinta y dos elementos porque está incompleto.
Estos dos últimos periodos tienen catorce elementos separados, para no alargar demasiado la tabla y facilitar su trabajo con ella.
El número del período indica la cantidad de niveles energéticos (órbitas) que tienen los átomos de los elementos que se ubican en dicho período. Así, el H y el He que están en el período 1 tienen una sola órbita; el Li al estar en el período 2 cuenta con dos órbitas, etcétera.
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos, Está constituida por 18 columnas o familias, las cuales se ordenan en grupos;. 8 grupos A y 8 grupos B.
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de I (un electrón en su último nivel de energía) y todos tienden a ceder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
Numerados de izquierda a derecha, según la última recomendación de la IUPAC (y entre paréntesis según la antigua propuesta de la IUPAC), los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos
Grupo 3 (III B): Familia del Escandio
Grupo 4 (IV B): Familia del Titanio
Grupo 5 (V B): Familia del Vanadio
Grupo 6 (VI B): Familia del Cromo
Grupo 7 (VII B): Familia del Manganeso
Grupo 8 (VIII B): Familia del Hierro
Grupo 9 (VIII B): Familia del Cobalto
Grupo 10 (VIII B): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Grupo 13 (III A): los térreos
Grupo 14 (IV A): los carbonoideos
Grupo 15 (V A): los nitrogenoideos
Grupo 16 (VI A): los calcógenos o anfígenos
Grupo 17 (VII A): los halógenos
Grupo 18 (VIII A): los gases nobles
En un grupo, las propiedades químicas son muy similares, porque todos los elementos del grupo tienen el mismo número de electrones en su última o últimas capas.
Ventajas e inconvenientes del sistema periódico de 18 columnas.
Las ventajas de esta ordenación en comparación con la de 8 columnas son:
1. Los períodos largos no se doblan ni alteran para forzarlos a una distribución en ocho columnas.
2. Desaparece la confusión creada por los subgrupos.
3. Existe una separación entre metales y no metales.
Los no metales quedan agrupados en la parte superior derecha por encima de la diagonal.
4. Los grupos encabezados por el Hierro (Fe), el Cobalto (Co) y el Níquel (Ni) tienen ya un lugar determinado.
Al examinar la tabla de periódica de los elementos químicos de 18 columnas puede verse que, si bien se han solucionado cuatro de los inconvenientes de la tabla de ocho columnas, el Hidrógeno (H) y los lantánidos y actínidos, todavía no tienen un lugar lógico en esta tabla.
Además, al dividir los períodos segundo y tercero, cada uno de los cuales tiene ocho elementos, se ha introducido un inconveniente nuevo. Los períodos se partieron para dar cabida a los elementos de transición.
Posibilidad que brinda la utilización del sistema periódico como instrumento de trabajo.
En general, la tabla periódica no es tan exacta como para que, conociendo las propiedades de un elemento de un grupo determinado, podamos predecir las propiedades exactas de los restantes elementos de dicho grupo. El sistema periódico orienta e indica una tendencia, pero no puede proporcionar detalles exactos. Sin embargo, su valor como guía para el estudio sistemático de las propiedades de los elementos y sus compuestos, compensa con mucho la desventaja que pueda suponer la falta de información detallada. Con la tabla periódica se puede predecir cómo combinar los distintos tipos de elementos, calcular masas y por ende cantidad de sustancia de las sustancias que pueden conformar la combinación de los elementos, así como conocer las propiedades periódicas de los átomos involucrados.
La tabla periódica es un instrumento utilísimo para organizar la química de los elementos y sus compuestos.
En la actualidad esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y nos permite deducir muchas de sus propiedades con sólo saber su situación en ella.
Fuente
http://html.rincondelvago.com/la-tabla-periodica_1.html
http://exa.unne.edu.ar/quimica/quimgeneral/UnidadIIINumerosCuanticos.pdf
Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985