Diferencia entre revisiones de «Tabla periódica de elementos»
(→Fuentes) |
(→Tabla larga) |
||
| Línea 172: | Línea 172: | ||
Se han propuesto diferentes tipos de tablas de formas largas: | Se han propuesto diferentes tipos de tablas de formas largas: | ||
| − | *[[ | + | *[[Tabla periódica de 18 columnas]]. |
*[[Separación en bloques de elementos]]. | *[[Separación en bloques de elementos]]. | ||
*de forma separada. | *de forma separada. | ||
Revisión del 10:42 16 may 2011
| ||||||||
Tabla Periódica de Elementos Químicos. La Tabla Periódica de Elementos Químicos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características. La misma se le atribuye al químico ruso Dimitri Ivánovich Mendeleyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev, fue diseñada por Alfred Werner.
Sumario
Historia
Ya desde la antiguedad eran conocidos algunos elementos químicos, siendo los alquimistas los artifices fundamentales de estos conocimientos químicos antes de llegar a definirse esta ciencia como tal. El oro (Au), la plata (Ag), el plomo (Pb) y otros elementos como el mercurio (Hg), el azufre (S), el arsénico (As), el estaño (Sn) y otros desde épocas antiguas, hasta descubrimientos más actuales como el fósforo (P) en 1669. Esto permitio que Antoine Lavoisier escribiera una lista de sustancias simples de 33 elementos, pero en 1830 está lista estaba ampliada a 55 elementos simples la cual se amplio con la invención del espectroscopio.
El estudio de las propiedades comunes y su clasificación, el surgimiento de la noción de masa atómica fueron formando los cimientos bajos los cuales se hizo posible el descubrimiento de la periodicidad de los elementos químicos en base a su número atómico y propiedades químicas teniendo como base un número suficiente de elementos individuales de la misma.
Elemento Químico
El propio concepto de elemento en su noción moderna se consolido a lo largo del siglo XVII, donde se le denomina elemento a "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros,..."
Primeras Tablas
Ya en el siglo XVIII aparecen las tablas de afinidad, en un intento de entender la composición química y ordenar los elementos. además permitio diferenciar en esa época que sustancias eran elementos químicos, y cuales no, así como sus propiedades y como obtenerlos.
Atomismo de Dalton
A principios del siglo XIX, comienza el desarrollo de una nueva concepción del atomismo gracias a los trabajos de John Dalton. los mismos se integraban a la definición de elementos dada por Lavoisier y otras leyes obtenidas empiricamente en aquellos tiempos. Dentro de ellas las leyes de las proporciones fueron utilizadas por Dalton para suponer como se combinaban los átomos estableciendo como unidad de referencia la masa de un átomo de hidrógeno (H)( además de usar como referencia la masa de un átomo de hidrógeno se utilizarón otros). y partir del mismo calculo el resto de las masas o pesos atómicos, por medio de esto pudo construir un sistema de masas atómicas relativas.
Clasificaciónes de los Elementos Químicos
Clasificación de Lavoisier
El propio Lavoisier dio la primera clasificación de elementos agrupando los mismos en:
- metales
- no metales
- metaloides o metales de transición
el cual fue rechazado producto de que existian muchas diferencias entre las propiedades físicas como químicas de los elementos agupados.
Triadas de Döbereiner
| Litio | LiCl
LiOH |
Calcio | CaCl2
CaSO4 |
Azufre | H2S
SO2 |
| Sodio | NaCl
NaOH |
Estroncio | SrCl2
SrSO4 |
Selenio | H2Se
SrO2 |
| Potasio | KCl
KOH |
Bario | BaCl2
BaSO4 |
Telurio | H2Te
TeO2 |
Otro intento por agrupar los elementos químicos con propiedades similares, fue dado por el químico alemán Johann Wolfgang Döbereiner, el cual puso de manifiesto el parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último, llamando a estos elementos triadas, hallándose en 1850 hasta 20 de estas manifestando la existencia de cierta regularidad entre los elementos químicos.
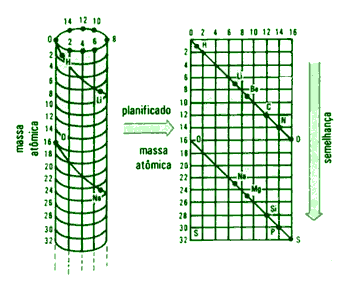
Hélices de Chancourtois
En 1864, Chancourtois construyó una hélice de papel, en la que se estaban ordenados por pesos atómicos los elementos
conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma línea vertical, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.
Ley de las Octavas de Newlands
| 1 | 2 |
3 |
4 |
5 |
6 |
7 |
| Li 6.9 Na 23.0 K 39.0 |
Be 9.0 Mg 24.3 Ca 40.0 |
B 10.8 Al 27.0
|
C 12.0 Si 28.1 |
N 14.0 P 31.0 |
O 16.0 S 32.1
|
F 19.0 Cl 35.5
|
En 1864 el químico inglés John A. Reina Newlands creo la ley de octavas, al percatarse que al ordenar los elementos en orden creciente de sus pesos atómicos (obviando el hidrógeno), el octavo elemento a partir de cualquier otro tenia propiedades muy similares al primero a partir del cual se contó.
Esta regularidad permitio la ordenación de los elementos en familias o grupos con propiedades muy parecidas entre sí y en periodos formados por 8 elementos cuyas propiedades iban variando progresivamente.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica.
Tabla Periódica de Mendeleyev
En 1869 Mendeleyev pubicó su primera tabla de elementos en Alemania, un año después lo hizo Julius Lothar Meyes.
En esta tabla los elementos se colocaron por orden creciente de sus masas atómicas, asi como en un mismo grupo los elementos con propiedades comunes como la valencia. La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B. En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos. Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléyev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka–aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka–sicilio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
Además de su tabla, Mendeleiev propuso la ley periódica donde se establecía que: Todos los elementos deben acomodarse en forma ascendente a partir de su masa atómica, sin embargo, ésta presentó problemas, pues algunos elementos no parecían tener lugar adecuado en la tabla de acuerdo a sus masa atómicas, ya que sus propiedades no eran similares a las de los elementos que les precedían o eran diferentes a los de los elementos del grupo que les correspondía.
Más tarde al conocer mejor la estructura atómica de los elementos, encontró mayor periodicidad en las propiedades físicas y químicas, ordenando los elementos en forma creciente basándose en su número atómico. A partir de esta clasificación, se modificó la ley periódica de Mendeleiev, estableciéndose la ley periódica moderna.
Tabla de Elementos Químicos
Tipos de tabla
Tabla corta
Tabla larga
En la imagen se aprecia que horizontalmente los elementos químicos se agrupan en Grupos, los cuales van desde el grupo IA hasta el VIIIA, agrupando cada uno elementos con propiedades similares, los mismos se distribuyen en 18 columnas (esta tabla también se le conoce como la tabla periódica de 18 columnas). además verticalmente se ordenan en periódos de 7 elementos , los mismos van desde el 1 hasta el 7 elementos,
Se han propuesto diferentes tipos de tablas de formas largas:
- Tabla periódica de 18 columnas.
- Separación en bloques de elementos.
- de forma separada.
Tabla larga extendida
- Tabla Periódica de 34columnas,
- Tabla Periódica de 32 columnas, etc.
El primer periodo tiene 2 elementos, el segundo y tercero tienen 8, el cuarto y quinto tienen 18 elementos, el sexto período 32 elementos y el séptimo hasta el momento se agota con 106 elementos.
Nuevas versiones alternativas a la tradicional