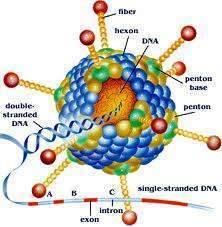
Vectores virales
| ||||||
Los vectores virales son una herramienta comúnmente utilizada por los biólogos moleculares para entregar el material genético en las células. Este proceso puede llevarse a cabo dentro de un organismo vivo (en vivo,) o en cultivos celulares (in vitro,).
Sumario
Vectores virales
Los virus han desarrollado mecanismos moleculares especializados para el transporte de manera eficiente de sus genomas dentro de las células que infectan. La entrega de los genes de un virus se llama transducción y las células infectadas se describen como transducidas.
Los biólogos moleculares primera aprovechado este mecanismo en la década de 1970. Paul Berg utilizó una modificación del ADN del virus SV40 que contiene el bacteriófago lambda para infectar las células de riñón de mono se mantienen en cultivo.
Los vectores virales se adaptan a sus aplicaciones específicas, pero en general comparten algunas propiedades fundamentales.
- Seguridad: A pesar de vectores virales en ocasiones creadas a partir de los virus patógenos, se modifican de tal manera que se minimice el riesgo de su manipulación. Esto normalmente implica la supresión de una parte del genoma viral esencial para la replicación viral. Un virus pueda infectar eficientemente a las células, pero, una vez que la infección ha tenido lugar, requiere de un virus auxiliar para proporcionar las proteínas que faltan para la producción de nuevos viriones.
- Baja toxicidad: El vector viral debe tener un mínimo efecto sobre la fisiología de la célula que infecta.
- Estabilidad: algunos virus son genéticamente inestables y rápidamente puede reorganizar sus genomas. Esto va en detrimento de la previsibilidad y la reproducibilidad de los trabajos realizados mediante un vector viral, y se evita en su diseño.
- Celulartipoespecificidad: La mayoría de los vectores virales están diseñados para infectar a la más amplia gama de tipos de células como sea posible. Sin embargo, a veces lo contrario se prefiere. El receptor viral pueden ser modificados para apuntar el virus a un tipo específico de célula.
- Identificación: Los vectores virales se dan a menudo ciertos genes que ayudan a identificar las células que se componen los genes virales. Estos genes se denominan marcadores, un marcador común es la resistencia a los antibióticos a un antibiótico determinado. Las células se pueden aislar fácilmente como los que no han asumido el vector viral genes no tienen resistencia a los antibióticos y por lo tanto no pueden crecer en una cultura con los antibióticos actuales.
Los Retrovirus
Los retrovirus son virus de ácido ribonucleico (ARN) que pueden encontrarse en diversas especies animales. El ARN viral contiene la información genética viral. Luego de infectar la célula, el ARN es convertido en ácido desoxiribonucleico (ADN). El ADN viral se inserta al azar en el genoma de la célula y de esta manera se convierte en parte de ella, replicándose cada vez que la célula infectada se replica y expresando los genes virales en respuesta a diversas señales celulares.
Un sistema retroviral para terapia genética necesita de dos componentes: el vector de expresión, el cual lleva el gen terapéutico y la célula empaquetadora. El vector retroviral está desprovisto de genes virales, dejando espacio para llevar el gen terapéutico. En el vector se conservan las secuencias de nucleótidos que sirven de señales para empaquetar la partícula viral y para lograr la inserción dentro del genoma celular. Este material genético es introducido dentro de la célula empaquetadora, la cual produce las proteínas virales necesarias para la formación de una partícula viral. El vector viral es producido y liberado al sobrenadante del cultivo celular. Este sobrenadante es utilizado para infectar las células o el tejido objetivo. Una vez que la célula objetivo es infectada, el material genético viral se integra al genoma celular. La ausencia de genes virales asegura que no haya producción de partículas virales. Luego de ser integrado, el gen terapéutico se expresa utilizando las enzimas de la célula hospedera.
Una de las preocupaciones en el desarrollo inicial de los vectores retrovirales fue la posibilidad de inserción del ADN retroviral cerca de genes que controlan la división celular (oncogenes), y así hacer que la célula se vuelva cancerosa. Modelos matemáticos han demostrado que esta posibilidad es muy pequeña para ser considerada significativa. Es necesario que el retrovirus sea capaz de replicarse y lo haga por muchos ciclos antes que haya una chance importante. En la práctica, luego de múltiples protocolos que han incluído cientos de pacientes, no se han reportado casos de transformación maligna debido a vectores retrovirales. Un estudio experimental en monos reportó la ocurrencia de leucemia posiblemente inducida por el vector retroviral, pero también se demostró que el vector había recombinado y era capaz de replicarse. Desde entonces, se han desarrollado nuevas generaciones de vectores y células empaquetadoras, con modificaciones específicas de las secuencias que determinan la producción de partículas virales y con mayores márgenes de seguridad para impedir la recombinación de los vectores y reducir aún más la posibilidad de generar virus con capacidad de replicación.
El vector retroviral ha sido el más utilizado en los protocolos de terapia genética, debido a la relativa facilidad de construcción de la expresión del gen transferido. El mayor problema de estos vectores es producir sobrenadantes con altas concentraciones (títulos) de vectores, pues la eficiencia de la transferencia de genes depende de estos títulos. Se han mejorado los métodos de producción y se están ensayando vectores utilizando proteínas de envoltura de otros virus, como la envoltura del virus de la estomatitis vescicular (VSV), la cual permite una mayor producción de partículas virales por célula. El vector retroviral requiere que las células objetivo estén dividiéndose, pues es necesario que la membrana nuclear desaparezca para permitir la integración del material genético retroviral. Este requerimiento limita el universo de tejidos y células que pueden utilizarse; sin embargo, la preferencia por células en división es aprovechada en la terapia genética del cáncer, para introducir genes que modifiquen sólo las células cancerosas y no el tejido sano. Una alternativa para el uso de vectores retrovirales en células que no se dividen son los lentivirus, como el virus de la inmunodeficiencia humana (VIH). Sin embargo, estos retrovirus son de mayor complejidad y los vectores desarrollados hasta el momento no han podido ser producidos en títulos suficientemente altos para ser eficientes en las transducción del gen terapéutico, aunque la capacidad de poder infectar células que no se dividen ha sido demostrada en neuronas y en otras líneas celulares irradiadas.
Los Adenovirus
Los adenovirus son virus de ADN de doble hebra, que producen infecciones del tracto respiratorio, y tienen tropismo por los epitelios respiratorio, gastrointestinal, y de la córnea. Para construir los vectores de adenovirus se han eliminado los genes de las proteínas tempranas E1a, E1b, E2 y E3, esenciales para la replicación viral. Estas modificaciones hacen al adenovirus deficiente, además de generar espacio para insertar el gen terapéutico. Los vectores de adenovirus pueden transducir genes de mayor longitud que los que pueden ser transducidos por vectores retrovirales.
Los vectores de adenovirus tienen gran eficiencia de transducción, aún en células que no están proliferando y pueden producirse en grandes concentraciones. Su tropismo por células epiteliales los hace bastante versátiles. Están siendo utilizados para el desarrollo de terapia genética para las dos enfermedades pulmonares hereditaria más frecuentes, la fibrosis quística y la deficiencia de anti-tripsina. Además, utilizando a los hepatocitos como células hospederas, se están ensayando vectores de adenovirus para el tratamiento de las deficiencias de factores de coagulación y de enzimas responsables del metabolismo de lípidos y carbohidratos.
Una importante característica de los adenovirus es que el material genético viral no se integra al genoma de la célula hospedera y se mantiene episomal. Esto hace que el riesgo de producir mutagénesis por inserción sea prácticamente nulo; sin embargo, la expresión del gen terapéutico en células que se están replicando se pierde con el transcurso del tiempo, pues no se divide con la célula. En experimentos in vivo, la expresión del gen terapéutico es bastante eficiente al inicio, pero luego se desvanece, entre uno y seis meses después. Un fenómeno que contribuye a la expresión transitoria del gen es el desarrollo de una respuesta inflamatoria, caracterizada por el aumento de interleuquinas, la aparición de anticuerpos contra proteínas de adenovirus y de síntomas clínicos inespecíficos, como fiebre y malestar general. A pesar de haberse eliminado la capacidad de replicación viral, aún se desarrolla una fuerte respuesta inmune contra las proteínas de las partículas virales, teniendo como consecuencia la desaparición de las células que albergan al gen terapéutico. Sin embargo, esta desventaja puede ser aprovechada en protocolos de terapia genética que requieren de una expresión temporal del gen terapéutico. Por ejemplo, la inducción de inmunidad a células cancerígenas puede realizarse expresando proteínas que aumentan el reconocimiento de estas células por el sistema inmune. Si resulta efectivo, las células cancerígenas perecerán y la duración temporal de la expresión del gen no tendrá significado.
Los virus asociados a adenovirus (VAA)
Estos virus pertenecen al grupo de parvovirus humanos, y son naturalmente deficientes en replicación, pues necesitan de la coinfección con adenovirus o virus de herpes simplex para iniciar el ciclo de replicación viral. Algunos estímulos celulares pueden también desencadenar la replicación del VAA, sin necesidad de la coinfección con otros virus, tales como la radiación gamma, la luz ultravioleta o el uso de hidroxiurea. No se ha encontrado evidencia que los asocie con alguna enfermedad, pese a su alta prevalencia. Sorprendentemente, la infección con parvovirus es correlacionada inversamente con la incidencia de carcinoma de cuello uterino. Algunos estudios sugieren que el responsable de este fenómeno es uno de sus genes, rep, que tiene características pertenecientes al grupo de genes supresores de tumores.
Los vectores basados en VAA transducen genes a diferentes tipos celulares con gran eficiencia, y no necesitan estar en estado proliferativo. No produce inflamación o alguna respuesta inmune significante y generalmente se integra específicamente en el cromosoma 19, en secuencias que no codifican genes. Esta última propiedad es importante, pues disminuye el riesgo de transformación maligna de la célula. La mayor desventaja es la poca capacidad para el tamaño del gen terapéutico, que sólo puede ser hasta de 4.7 kb. El proceso de purificación puede ser difícil en algunos casos, cuando la presencia de adenovirus contaminante es importante.
Los virus del herpes simple(HSV)
Los virus del Herpes Simplex son virus de ADN de doble hebra, con tropismo por las células del sistema nervioso. Estos virus establecen una infección latente en las neuronas, generalmente benigna. El virus se replica en el epitelio ocular o en el orofacial, invade terminaciones nerviosas locales, asciende a los ganglios utilizando el transporte retrógrado axonal y se mantiene en las neuronas sensoriales en un estado latente. El virus es reactivado sólo bajo ciertos estímulos celulares, en los cuales se induce la expresión de proteínas tempranas, y se inicia el ciclo de lisis y replicación.
Para la construcción de un vector basado en el HSV se han utilizado dos estrategias, una de ellas es similar al utilizado para los vectores de adenovirus, en este caso se elimina las secuencias de genes que expresan las proteínas tempranas ICPO, ICP4, ICP22 y ICP27, haciendo un vectordeficiente para replicarse. Genes de hasta 15 kb pueden ser transducidos por un vector de HSV. La segunda estrategia consiste en construir un "mini-HSV", con las mínimas secuencias necesarias para la formación de la partícula viral y la infección de la neurona. Requieren de algunas proteínas para la formación de la partícula viral y la infección de la neurona a través de una célula empaquetadora. Los sistemas de vectores basados en HSV necesitan de mayores pruebas de seguridad, pues la patofisiología de la infección viral no está del todo esclarecida. Los primeros ensayos con vectores de HSV han presentado cierto grado de citotoxicidad no esperada y son necesarias mayores modificaciones que eliminen este fenómeno.
Algunas aplicaciones de los vectores virales
Inicialmente la terapia genética fue concebida para corregir enfermedades hereditarias tales como la fibrosis quística, enfermedad en que el gen responsable ya había sido identificado. Sin embargo, su uso para otro tipo de enfermedades fue prontamente explorado, actualmente mas del 90% de los protocolos de terapia genética están dirigidos al tratamiento de enfermedades adquiridas, tales como el cáncer y el SIDA.
La deficiencia de adenosin deaminasa (ADA)
La deficiencia de ADA ha sido escogida por múltiples razones como la enfermedad modelo para el desarrollo de la tecnología de la terapia genética. El gen ha sido bastante estudiado y su función y regulación están bien definidas. Además, el gen se expresa constantemente y es pequeño, lo cual resulta conveniente para el desarrollo de vectores retrovirales, pues tienen limitada capacidad para albergar genes extensos. La deficiencia de ADA resulta en la enfermedad denominada inmunodeficiencia combinada severa (SCID). La ADA interviene en el metabolismo de las purinas, su deficiencia causa la acumulación tóxica de metabolitos que bloquean la diferenciación de los linfocitos T en el timo. El rango de severidad de la enfermedad es variable, presentándose generalmente en los primeros meses de vida con infecciones recurrentes de la piel y del aparato respiratorio. Los tratamientos disponibles son el transplante de médula ósea, con una respuesta favorable en más de 90% cuando se encuentra un donante apropiado; y el reemplazo de la enzima con una preparación de ADA bovina conjugada con polietilenglicol (PEG-ADA). Esta preparación restablece los parámetros inmunológicos en forma significativa, aunque debe ser administrada periódicamente y es costosa.
Los estudios pre-clínicos de terapia genética para la deficiencia de ADA lograron la transferencia del gen en ratones, primates y células hematopoiéticas humanas in vitro, utilizando vectores retrovirales. En 1990, el primer ensayo clínico de terapia genética consistió en el tratamiento de dos pacientes con deficiencia de ADA, en los que el tratamiento con PEG-ADA no había resultado favorable. El protocolo consistió en transferir el gen de ADA a linfocitos T aislados por aféresis de los propios pacientes y reinfundirlas una vez expandidas. Los parámetros inmunológicos mejoraron. La inmunidad celular y la humoral fueron restablecidas. Sin embargo es difícil concluir que el experimento fue un éxito, pues los pacientes continuaron recibiendo PEG-ADA. Un protocolo en tres infantes en los que la transferencia del gen fue hecha a células hematopoiéticas derivadas de cordón umbilical mostró la permanencia del vector en 1 en 3000 linfocitos, luego de diez meses de la transferencia. Sin embargo, la expresión de ADA no se incrementó significativamente. No se conocen los datos de la restauración del sistema inmune; sin embargo, estos pacientes también son tratados con PEG-ADA. Estos protocolos han demostrado que es posible transducir el gen a las células progenitoras, y que éstas producen células que expresan el gen transducido y permanecen en la circulación periférica por un buen periodo de tiempo. Además, es alentador que no se encontraron efectos colaterales, como la producción de retrovirus recombinantes o la inserción al azar que produzca neoplasias secundarias a mutagénesis.
El Cáncer
El tratamiento del cáncer está dirigido a destruir tejido canceroso sin afectar el tejido sano. Sin embargo, a pesar de los avances en cirugía, quimioterapia y radioterapia, este objetivo es rara vez obtenido, siendo imposible cuando los tumores son inaccesibles o muy diseminados. Las estrategias de terapia genética para el tratamiento del cáncer son diversas y pueden asociarse en cuatro grupos: el reemplazo de genes supresores de tumores, el bloqueo de genes promotores de la división celular, la activación genética de pro-drogas citotóxicas y la activación de la inmunidad específica contra determinados tumores.
Las mutaciones de los genes supresores de tumores resultan en neoplasia. P53 es un gen que detiene el crecimiento celular cuando el ADN ha sido dañado. Los experimentos in vitro que reemplazan el gen dañado con una copia normal, demuestran una disminución en la proliferación celular y un aumento de apoptosis del tejido tumoral. Pacientes con cáncer de pulmón con mutaciones de p53 actualmente están siendo tratados con un vector retroviral que lleva el gen p53 normal, con variados resultados . Otros genes supresores de tumores son el gen de retinoblastoma, y los genes APC, DPC4, asociados a neoplasia de colon.
El bloqueo de genes promotores de división celular puede realizarse a través de secuencias de nucleótidos anti-sentido, con la habilidad de formar un híbrido no funcional con las secuencias de estos genes cancerígenos. Los vectores virales expresan estos genes anti-sentido dentro de las células, con el efecto de detener la división celular. Ejemplos de estos oncogenes son myc, ras, erb1. La estrategia de la activación genética de prodrogas consiste en introducir genes que codifican enzimas activadoras de drogas citotóxicas, en células tumorales. De esta manera, solo éstas células serán afectadas cuando se administre la droga. Varios ensayos clínicos están siendo llevados a cabo con la enzima timidina kinasa, que activa la droga ganciclovir y la vuelve citotóxica, matando a la célula. En ensayos con modelos de tumores cerebrales, inicialmente el tumor regresiona, pero las recurrencias son frecuentes. Los efectos son más impresionantes en modelo de ratones con mesoteliomas, gliomas intracerebrales y carcinoma de colon.
El desarrollo de la inmunología de tumores ha permitido identificar citoquinas, antígenos y moléculas de superficie necesarios para la respuesta inmune antitumoral. Muchas estrategias de terapia genética son dirigidas a estimular esta respuesta mediante la introducción de genes que codifican estos factores, y de esta manera reducir la masa tumoral. Este concepto es usado con mayor ventaja en pacientes que presentan múltiples metástasis, o diseminación del cáncer, pues el sistema inmune puede actuar localizando específicamente a las células cancerosas, y ejercer su potencial citotóxico en donde localice las células malignas.
Fibrosis Quística
Es la enfermedad genética letal más común en la población caucásica. Generalmente se presenta con una inusual frecuencia de infecciones respiratorias. El gen responsable de esta enfermedad es el regulador de la conductancia de membrana de la fibrosis quística (CFTR). El defecto de este gen hace que se produzcan secreciones muy viscosas en el aparato respiratorio, favoreciendo el desarrollo de neumonías y la producción de cambios crónicos que comprometen progresivamente la función pulmonar. En el páncreas, provoca insuficiencia pancreática y en consecuencia, malabsorción intestinal, en los testículos, produce esterilidad. No existe tratamiento específico, solo el tratamiento de las complicaciones.
Los estudios de terapia genética en fibrosis quística han demostrado que el gen puede ser transferido utilizando adenovirus en aerosol, dirigidos al epitelio pulmonar. Los adenovirus tienen tropismo por este epitelio y son los vectores más utilizados para llevar el gen de la fibrosis quística. Los ensayos clínicos iniciales están siendo aplicados al epitelio nasal de los pacientes, y se demuestra que la transferencia de genes y la corrección del defecto son efectivas en un 50%. Sin embargo, el uso de grandes dosis produce inflamación de la mucosa, posiblemente debido a la respuesta inmune a las proteínas del adenovirus. Actualmente se están ensayando vectores con menos secuencias virales a fin de evitar esta respuesta inflamatoria. Otros protocolos son dirigidos a estudiar la administración de los vectores al parénquima pulmonar, de manera que sea efectiva para normalizar la fluidez de las secreciones y disminuir la incidencia de infecciones.