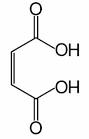
Ácido maleico
| ||||||
El ácido maleico. Ácido cis-butenodioico o (Z)-ácido butenodioico, es un compuesto orgánico perteneciente al grupo de los ácidos dicarboxílicos. Se conoce con otros nombres como ácido malénico, el ácido maleinico y ácido toxilico. Su fórmula química es C4H4O4.
Sumario
Propiedades físicas
- EL ácido maleico es el isómero del ácido cis-butenodioico, mientras que el ácido fumárico es el isómero trans.
- Su estado de agregación es sólido en forma de cristales blancos.
- Punto de fusión: 131°C
- Se descompone por debajo del punto de ebullición a 135°C
- Solubilidad en agua: Elevada (44 g/100 ml a 25°C).
- Densidad relativa de vapor (aire = 1): 4
- Densidad relativa (agua = 1): 1.59
- Masa molecular: 116.07 g/mol
Peligros químicos
Combustible
La sustancia se descompone al calentarla intensamente y al arder, produciendo humos altamente irritantes de anhídrido maleico. La disolución en agua es moderadamente ácida. En caso de incendio se despreden humos (o gases) tóxicos e irritantes.
Ingestion
La sustancia se puede absorber por inhalación, a través de la piel y por ingestión.
- Riesgo de inhalación
La evaporación a 20°C es despreciable; sin embargo, se puede alcanzar rápidamente una concentración nociva de partículas en el aire cuando se dispersa, especialmente si está en forma de polvo.
- Efectos de exposición de corta duración
La sustancia irrita los ojos, la piel y el tracto respiratorio.
- Efectos de exposición prolongada o repetida
El contacto prolongado o repetido con la piel puede producir dermatitis y puede afectar al riñón.
Aplicaciones
El ácido maleico se emplea en la fabricación de resinas sintéticas y en síntesis orgánicas, actúa como conservante de aceites y grasas y sus sales se utilizan en la tinción de algodón, lana y seda.
Esta resina poliéster insaturada, tiene múltiples aplicaciones, como elaboración de botes, muebles de baño (refuerzos de spas y tina de hidromasaje, lavamanos, tarjas y WC), bases de cocina, sillas, concreto polimérico, losetas, autopartes, tuberías, tanques de almacenamiento. Fabricación de resina alquidal, que es la base de las pinturas alquidálicas que se aplican en pinturas automotrices y arquitectonicas. Elaboración de fertilizantes y agroquímicos, tales como el ácido fumárico. El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis. Es un reactivo que se utiliza mucho en síntesis química de Diels-Alder.
Maleatos
El ion maleato es la forma ionizada del ácido maleico. Es útil en la bioquímica como un inhibidor de las reacciones de las transaminasas. Los ésteres del ácido maleico también se le llaman maleatos, por ejemplo, maleato de dimetilo.
Obtención
En la industria, el ácido maleico se deriva del anhídrido maleico por hidrólisis. El anhídrido maleico se produce a partir de benceno o de butano en un proceso de oxidación. El ácido maleico se convierte en anhídrido maleico por deshidratación, al ácido málico por la hidratación, y el ácido succínico por hidrogenación (etanol/paladio sobre carbono). Reacciona con el cloruro de tionilo o pentacloruro de fósforo para dar el cloruro de ácido maleico (que no es posible aislar el cloruro de ácido mono).
Fuentes
- Bonner WA, Castro AJ. Química Orgánica Básica. 2 ed. La Habana; Editorial Pueblo y Revolución. 1979
- ISOMERÍA. Articulo disponible en:El ácido maleico
- Seguridad Profesiones y Productos quimicos. Articulo disponible en:Ácidos Orgánicos
- Ácido. Articulo disponible en:La enciclopedia libre