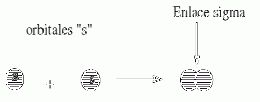Enlace sigma
| ||||||
El Enlace sigma . Es un tipo de enlace covalente, que se forma por hibridación de orbitales atómicos. El enlace sigma puede formarse como producto de la hibridación de dos orbitales s, un orbital s y uno p, o dos orbitales p que se hibridan lateralmente.
Sumario
Origen
En química, el enlace sigma es el tipo más fuerte de enlace químico covalente, incluso más fuerte que el enlace pi, el cual forma el doble enlace. El orbital sigma se define de forma más clara para moléculas diatómicas usando el lenguaje y las herramientas de la simetría de grupos. El enlace sigma es uno de los enlaces más fuertes, con mayor estabilidad. La densidad electrónica se dispone de manera simétrica entre los núcleos de los átomos.
Teoría de orbitales moleculares
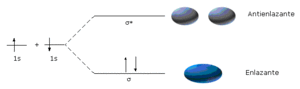
De acuerdo con la teoría de orbitales moleculares, cuando dos electrones forman un enlace covalente, sus orbitales atómicos se traslapan, formando un orbital molecular que pasa a depender de dos o más núcleos de la molécula. Según esta teoría, el número de orbitales moleculares formados es igual al número de orbitales atómicos que lo formaron, es decir que cuando dos orbitales atómicos se traslapan, se forman dos orbitales moleculares, uno llamado enlazante, y otro antienlazante. De esta manera, cuando dos orbitales s se hibridan, se forma un orbital sigma (s) enlazante y un orbital (s*) antienlazante. El orbital enlazante es de menor energía que los orbitales atómicos que lo formaron, y el antienlazante tiene mayor energía, por lo tanto los electrones ocupan el orbital molecular enlazante primero, dejando vacío el orbital antienlazante.
Esta teoría es fácilmente aplicable a moléculas diatómicas, sobre todo si los átomos son pequeños e iguales. El clásico ejemplo de enlace sigma es el que se forma en la unión de dos átomos de hidrógeno. Cada átomo tiene un solo electrón en el orbital 1s, cuando se unen mediante enlace covalente, los orbitales 1s de cada átomo se hibridan, ocupando ambos electrones el orbital molecular enlazante sigma. En moléculas poliatómicas, la aplicación de esta teoría es mucho más compleja, para encontrar la mayor estabilidad de la molécula hay que considerar varios enlaces entre distintos núcleos y la formación de los distintos orbitales moleculares. De todas maneras, para evitar cálculos tan complejos, sobre todo desde el punto de vista matemático, se aceptan algunas simplificaciones, por ejemplo, se admite que los orbitales moleculares se ubican esencialmente entre los dos núcleos que lo formaron, y que su forma y orientación tienen similitud con las de los orbitales atómicos que se hibridaron para conformarlo. Con estas simplificaciones se puede explicar la geometría y los parámetros de enlace de la mayoría de las moléculas, aunque no de todas.
Compuestos poliatómicos
Se obtienen por traslape frontal de los orbitales atómicos. El concepto de enlace sigma alcanza a describir, aunque en forma difusa, las interacciones enlazantes que involucran el traslape de sólo un lóbulo de un orbital con sólo un lóbulo de otro. Por ejemplo, el propano es descrito como que consiste de diez enlaces sigma, uno por cada uno de los dos enlaces C-C y uno por cada uno de los ocho enlaces C-H. El enlace σ en tal molécula poliatómica está altamente deslocalizado, produciéndose conflictos con el concepto de dos orbitales-un enlace. A pesar de esta complicación, el concepto de enlace σ es extremadamente poderoso y en consecuencia perdura.
Enlaces múltiples
Los compuestos que contienen enlaces múltiples, tales como el etileno y el acetato de cromo(II) tienen enlaces sigma entre los átomos unidos por enlace múltiple. Estos enlaces sigma están suplementados por enlaces π, como en el caso del etileno, e incluso por enlaces δ, en el caso del acetato de cromo (II).