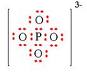
Ion poliatómico
| ||||||
Los Iones Poliatómicos se define como una especie química, ya sea un átomo o una molécula cargada eléctricamente. Esto se debe a que ha ganado o perdido electrones en una reacción química. Los iones cargados negativamente producidos por la ganancia de electrones se conocen como aniones, y los cargados positivamente como consecuencia de la pérdida de electrones, se les conoce como cationes.
Sumario
Propiedades
- Un ión poliatómico es un grupo de dos o más átomos que están químicamente unidos y tienen carga positiva o negativa, y que son considerados como una unidad en las reacciones químicas.
- Los iones poliatómicos más comunes tienen carga negativa. Esto significa que el grupo de átomos ha ganado electrones. Por ejemplo, el ión fosfato, PO43- ha ganado tres electrones extra (además de los que ya tenían los átomos de fósforo y oxígeno).
- Los electrones son compartidos por todos los átomos del ión poliatómico.
- El ión poliatómico con carga positiva más común es el amonio NH41+.
- En la mayoría de los iones poliatómicos, existe un átomo central, alrededor del cual se sitúan los demás átomos.
- Generalmente son átomos de oxígeno los que rodean el átomo central, y en este caso el ion es llamado oxoanión. Muchos oxoaniones son bases débiles y reaccionan con hidrógeno para formar ácidos o sales ácidas, tal es el caso del ácido sulfúrico H2SO4 y el ácido nítrico HNO3.
Los oxoaniones también pueden formar bases fuertes, como KOH (hidróxido de potasio) o soda cáustica NaOH.
Presencia de oxígeno
Los iones poliatómicos más frecuentes contienen oxígeno, puesto que este elemento es el más abundante de la corteza terrestre, el segundo más abundante de la atmósfera y el más abundante en peso en la hidrosfera.
La presencia de oxígeno en la Tierra explica que la mayoría de los materiales cedan electrones a los átomos de oxígeno, por ser éste el segundo elemento más electronegativo (3'5 en la escala de Pauling, sólo superado por el flúor, con 4'0). No obstante, sólo considerando la ingente cantidad de moléculas de agua de la hidrosfera, los iones hidroxilo e hidronio (OH- y H3O+), derivados de la autoprotólisis del agua, deben ser los más abundantes, con mucho, de los iones poliatómicos. Los ácidos y bases, o pares de ácidos y bases conjugados, como el ión bicarbonato HCO3- / carbonato CO32-, el sulfato completamente disociado SO4(2-), y toda la serie de la disolución tampón ácido fosfórico, dihidrogenofosfato: H2PO4- / hidrogenofosfato: HPO42-) / fosfato: PO43- sean los siguientes en abundancia, ya que los oxoácidos son de por sí poliatómicos y muchos no-metales (incluso algunos semimetales) forman ácidos poliatómicos con él.
Nomenclatura de los iones poliatómicos.
- Algunos compuestos que tienen electrones libres, y reaccionan con hidrógeno, cediéndole estos electrones y transformándose en cationes poliatómicos. Para nombrar estos cationes se añade la terminación –onio.
- Los iones poliatómicos más comunes son los oxoaniones, formados por un átomo central y varios átomos de oxígeno. La nomenclatura moderna los nombra a todos agregando el sufijo –ato al nombre del elemento central y entre paréntesis, en números romanos, el número de oxidación del átomo central.
Ejemplo:
- SO42- sulfato (VI)
- SO32- sulfato (IV)
Algunos oxoaniones se protonan parcialmente, y para nombrar dichos aniones debemos agregar al principio la palabra hidrógeno.
Si se protonan con más de un átomo de hidrógeno, de debe indicar con el prefijo “ di” o el que corresponda. Por ejemplo:
• oxoanión fosfato (V) PO43-
• oxoanión hidrógeno fosfato (V) HPO42-
• oxoanión dihidrógeno fosfato (V) H2PO4-
Iones más comúnes
- NO2 - nitrito,
- NO3- nitrato,
- SO3 2- sulfito,
- SO4 2- sulfato,
- CO3 2- carbonato,
- PO2 -, metafosfito,
- P2O5 4- pirofosfito,
- PO3 3- ortofosfito,
- PO3 - ortofosfato,
- P2O7 4- pirofosfato,
- PO4 3- ortofosfato,
- BO2- metaborato,
- BO3 3- ortoborato,
- SiO3 2- metasilicato,
- SiO4 4- ortosilicato,
- ClO- hipoclorito,
- ClO2 - clorito,
- ClO3 - clorato,
- ClO4- perclorato,
- OH- hidroxido,
- Zn(OH)4 2- ion cianato,
- Al(OH)4- ion aluminato,
- Cr(OH)4- ion cromito,
- Sn(OH)3 - ion estannito,
- Pb(OH)3 - ion plumbito,
- Fe(OH)4 - ion ferrito,
- Sn(OH)6 2- ion estaniato,
- Pb(OH)6 2- ion plumbato,
- AsO4 2- arseniato,
- Sb(OH)- ion antimonito.
Clasificación
En los iones negativos, aniones, cada electrón, del átomo originalmente neutro, está fuertemente retenido por la carga positiva del núcleo. Al contrario que los otros electrones del átomo, en los iones negativos, el electrón adicional no está vinculado al núcleo por fuerzas de Coulomb, lo está por la polarización del átomo neutro. Debido al corto rango de esta interacción, los iones negativos no presentan series de Rydberg, Un átomo de Rydberg es un átomo con uno o más electrones que tienen un número cuántico principal muy elevado.
Los cationes son iones positivos. Son especialmente frecuentes e importantes los que forman la mayor parte de los metales. Son átomos que han perdido electrones
Otros iones
- Un dianión es una especie que tiene dos cargas negativas sobre ella. Por ejemplo: el dianión del pentaleno es aromático.
- Un zwitterión es un ion con una carga neta igual a cero pero que presenta dos cargas aisladas sobre la misma especie, una positiva y otra negativa por lo tanto es negativo
- Los radicales iónicos son iones que contienen un número irregular de electrones y presentan una fuerte inestabilidad y reactividad.
Se denomina plasma a un fluido gaseoso de iones. Incluso, se puede hablar de plasma en muestras de gas corriente que contengan una proporción apreciable de partículas cargadas. Se puede considerar a un plasma como un nuevo estado de la materia, (aparte de los estados sólido, líquido y gaseoso), concretamente el cuarto estado de la materia, puesto que sus propiedades son muy distintas a los estados usuales. Los plasmas de los cuerpos estelares contienen, de manera predominante, una mezcla de electrones y protones, estimándose que su proporción es del 99,9% del universo visible.
Aplicaciones de los iones
Los iones son esenciales para la vida. Los iones sodio, potasio, calcio y otros, juegan un papel esencial en la biología celular de los organismos vivos, en particular en las membranas celulares. Hay multitud de aplicaciones basadas en el uso de iones y cada día se descubren más, desde detectores de humo hasta motores iónicos. Los Iones de Plata Ag+ han sido utilizados también como germicidas para el tratamiento de diversas enfermedades infecciosas. Los iones inorgánicos disueltos son un componente de los sólidos (sólidos totales disueltos) presentes en el agua e indican la calidad de esta.
Fuente
- Libro de texto de Química. Secundaria Básica. Parte 2
- Sales I. Estudio General.
- Kleinberg,jw.j.argersinger y k.griswold: química inorgánica, traducido por beltrán. editorial reverte s.s barcelona,1972.