Pila electroquímica
| ||||
Una Pila electroquímica es un dispositivo capaz de obtener energía eléctrica a partir de reacciones químicas, o bien, de producir reacciones químicas a través de la introducción de energía eléctrica. Un ejemplo común de celda electroquímica es la "pila" estándar de 1,5 voltios. En realidad, una "pila" es una celda galvánica simple, mientras una batería consta de varias celdas conectadas en serie.
Sumario
Pila
Las pilas son los elementos primarios irreversibles, como las pilas de linterna o de radio, mientras que celdas, baterías o acumuladores son los elementos secundarios reversibles, como en los autos, los montacargas, las plantas telefónicas o las instalaciones solares fotovoltaicas en los consultorios del médico de la familia, círculos sociales o escuelas rurales.
Irreversible significa que las reacciones químico-eléctricas que ocurren en la descarga son en un solo sentido hasta el total agotamiento de los electrodos.
En las celdas reversibles el proceso ocurre en dos sentios, es decir, en la descarga la celda entrega corriente y en la carga la celda recibe corriente que es almacenada, químicamente.
Notación de una pila
En primer lugar se escribe el material del electrodo negativo utilizando su símbolo químico, luego se coloca una línea vertical para separar el electrodo de la solución de iones de concentración determinado.
Inmediatamente se usa el símbolo II para señalar el puente salino, a continuación se coloca la segunda solución iónica de concentración conocida el signo II y por último el signo del metal:
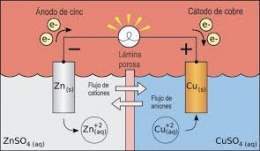
Zn (.) I Zn 2+ (1mol/L) II Cu 2+(1mol/L) I Cu (.)
Todas estas son notaciones convencionales de la celda
Las celdas que producen energía eléctrica se llaman celdas galvánicas, las que son causadas por el consumo de energía química.
Las celdas que consumen energía son las celdas electroquímicas; consumen corriente de una fuente de corriente externa, almacenando como consecuencia energía química electrolítica.
Tipos de celdas
Hay dos tipos fundamentales de celdas y en ambas tiene lugar una reacción redox, y la conversión o transformación de un tipo de energía en otra:
- La celda voltaica transforma una reacción química espontánea en una corriente eléctrica, como las pilas y baterías. También reciben los nombres de celda galvánica, pila galvánica o pila voltaica. Son muy empleadas por lo que la mayoría de los ejemplos e imágenes de este artículo están referidos a ellas.
- La celda electrolítica transforma una corriente eléctrica en una reacción química de oxidación-reducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrolisis. También reciben los nombres de celda electrolítica o cuba electrolítica. A diferencia de la celda voltaica, en la célula electrolítica, los dos electrodos no necesitan estar separados, por lo que hay un sólo recipiente en el que tienen lugar las dos semirreacciones.
Semiceldas en una celda voltaica
Una celda galvánica o celda voltaica consta de dos semiceldas conectadas eléctricamente mediante un conductor metálico, y también mediante un puente salino. Cada semicelda consta de un electrodo y un electrolito. Las dos semiceldas pueden utilizar el mismo electrolito, o pueden utilizar electrolitos diferentes. Las reacciones químicas en la celda pueden implicar al electrolito, a los electrodos o a una sustancia externa (como en las pilas de combustible que puede utilizar el hidrógeno gaseoso como reactivo). En una celda voltaica completa, las especies químicas de una semicelda pierden electrones (oxidación) hacia su electrodo mientras que las especies de la otra semicelda ganan electrones (reducción) desde su electrodo. Un puente salino se emplea a menudo para proporcionar un contacto iónico entre las dos medias celdas con electrolitos diferentes, para evitar que las soluciones se mezclen y provoquen reacciones colaterales no deseadas. Este puente salino puede ser simplemente una tira de papel de filtro empapado en solución saturada de nitrato de potasio. Otros dispositivos para lograr la separación de las disoluciones son vasijas porosas y disoluciones gelificadas. Un recipiente poroso se utiliza en la pila de Bunsen (derecha).
También se les denomina semirreacciones pues en cada una de ella tiene lugar una parte de la reacción redox:
- La pérdida de electrones (oxidación) tiene lugar en el ánodo.
- La ganancia de electrones (reducción) en el cátodo.
Reacción de equilibrio
Cada semicelda tiene una tensión característica llamada potencial de semicelda o potencial de reducción. Las diferentes sustancias que pueden ser escogidas para cada semicelda dan lugar a distintas diferencias de potencial de la celda completa, que es el parámetro que puede ser medido. No se puede medir el potencial de cada semicelda, sino la diferencia entres los potenciales de ambas. Cada reacción está experimentando una reacción de equilibrio entre los diferentes estados de oxidación de los iones; cuando se alcanza el equilibrio, la célula no puede proporcionar más tensión. En la semicelda que está sufriendo la oxidación, cuanto más cerca del equilibrio se encuentra el ion/átomo con el estado de oxidación más positivo, tanto más potencial va a dar esta reacción. Del mismo modo, en la reacción de reducción, cuanto más lejos del equilibrio se encuentra el ion/átomo con el estado de oxidación más negativo, más alto es el potencial.
Potenciales de electrodo
El potencial o fuerza electromotriz de una pila se puede predecir a través de la utilización de los potenciales de electrodo, las tensiones de cada semicelda. La diferencia de voltaje entre los potenciales de reducción de cada electrodo da una predicción para el potencial medido de la pila.
Los potenciales de pila tienen un rango posible desde 0 hasta 6 voltios. Las pilas que usan electrolitos disueltos en agua generalmente tienen potenciales de celda menores de 2,5 voltios, ya que los oxidantes y reductores muy potentes, que se requerirían para producir un mayor potencial, tienden a reaccionar con el agua.
Tipos de celdas galvánicas
Las celdas o células galvánicas se clasifican en dos grandes categorías:
- Las células primarias transforman la energía química en energía eléctrica, de manera irreversible (dentro de los límites de la práctica). Cuando se agota la cantidad inicial de reactivos presentes en la pila, la energía no puede ser fácilmente restaurada o devuelta a la celda electroquímica por medios eléctricos.
- Las células secundarias pueden ser recargadas, es decir, que pueden revertir sus reacciones químicas mediante el suministro de energía eléctrica a la celda, hasta el restablecimiento de su composición original.
Celdas galvánicas primarias
Las celdas galvánicas primarias pueden producir corriente inmediatamente después de su conexión. Las pilas desechables están destinadas a ser utilizadas una sóla vez y son desechadas posteriormente. Las pilas desechables no pueden ser recargadas de forma fiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos no pueden volver a su forma original.
Generalmente, tienen densidades de energía más altas que las pilas recargables,4 pero las células desechables no van bien en aplicaciones de alto drenaje con cargas menores de 75 ohmios (75 Ω).
Celdas galvánicas secundarias
Las celdas galvánicas secundarias debe ser cargadas antes de su uso; por lo general son ensambladas con materiales y objetos activos en el estado de baja energía (descarga). Las celdas galvánicas recargables o pilas galvánicas secundarias se pueden regenerar (coloquialmente, recargar) mediante la aplicación de una corriente eléctrica, que invierte la reacciones químicas que se producen durante su uso. Los dispositivos para el suministro adecuado de tales corrientes que regeneran las sustancias activas que contienen la pila o batería se llaman, de modo inapropiado, cargadores o recargadores.
La forma más antigua de pila recargable es la batería de plomo-ácido. Esta celda electroquímica es notable, ya que contiene un líquido ácido en un recipiente sellado, lo cual requiere que la celda se mantenga en posición vertical y la zona de estar bien ventilada para garantizar la seguridad de la dispersión del gas hidrógeno producido por estas células durante la sobrecarga. La celda de plomo-ácido es también muy pesada para la cantidad de energía eléctrica que puede suministrar. A pesar de ello, su bajo costo de fabricación y sus niveles de corriente de gran aumento hacen que su utilización sea común cuando se requiere una gran capacidad (más de 10A·h) o cuando no importan el peso y la escasa facilidad de manejo. Batería de plomo-ácido con celdas de fieltro de vidrio absorbente, mostrando aparte los dos electrodos y, en medio, el material de vidrio absorbente que evita derrames del ácido. Un tipo mejorado de la celda de electrolito líquido es la celda de plomo-ácido regulada por válvula de sellado (VRLA,por sus siglas en inglés), popular en la industria del automóvil como un sustituto para la celda húmeda de plomo-ácido, porque no necesita mantenimiento. La celda VRLA utiliza ácido sulfúrico inmovilizado como electrolito, reduciendo la posibilidad de fugas y ampliando la vida útil.7 Se ha conseguido inmovilizar el electrolito, generalmente por alguna de estas dos formas:
Fuente
- Química. American Chemical Society. Editorial Reverté, 2005. ISBN: 8429170014. Pág. 680
- Alkaline Manganese Dioxide Handbook and Application Manual (PDF). Energizer. Retrieved 25 August 2008.
- Buchmann, Isidor. Will secondary batteries replace primaries?. Battery University. Último acceso: 6 Enero 2008.
- Buchmann, Isidor. Can the lead-acid battery compete in modern times?. Battery University. Último acceso: 2 Septiembre 2007.
- Dynasty VRLA Batteries and Their Application. C&D Technologies, Inc. Último acceso: 26 Agosto 2008.
- What's the best battery?. Battery University. Último acceso: 26 Agosto 2008.
- a b Buchmann, Isidor. Battery statistics. Battery University. Último acceso: 11 Agosto 2008.