Polarógrafo
| ||||||
Polarografo: instrumento para estudiar procesos polarográficos, constituido básicamente por una fuente de potencial E y un instrumento para la medida de la corriente, acoplados a una célula con un electrodo de gotas de mercurio (EGM) y un electrodo auxiliar que actúa de electrodo de referencia (ECS). Este dispositivo varía sustancialmente en función de la técnica polarográfica correspondiente.
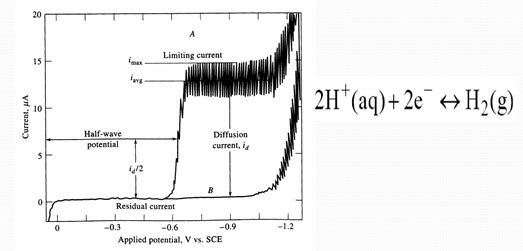
Polarograma: curva intensidad de corriente potencial correspondiente a un proceso polarográfico. Cada onda polarográfica viene caracterizada por el potencial de onda media y la intensidad de corriente límite.
La Polarografía es una subclase de voltamperometría donde el electrodo de trabajo es un electrodo de gota de mercurio (DME), útil por su amplio rango catódica y su superficie renovable. La polarografía es una medida voltamperométrica cuya respuesta está determinada por el transporte combinado de masa difusión/convección.
La Polarografía clásica fue la primera técnica no destructiva de análisis de trazas, aunque su límite de detección no alcanzaba más allá de 0,5.10-5 M, por lo que es inoperante en la resolución de problemas en que la sustancia a determinar esté en menor concentración.
Los métodos polarográficos modificados brindan mayor sensibilidad, con gran exactitud en mediciones de discriminación de elementos químicos, como en especificación de concentración. Es una técnica que en complemento con otras técnicas de análisis es una herramienta valiosa.
Sumario
Técnicas Polarográficas
- Polarografía de corriente continua: forma clásica de Polarografía en la que se aplica una rampa de voltaje lineal al electrodo de trabajo.
- Polarografía diferencial de impulsos: técnica basada en la medida de la corriente al principio y al final del impulso de potencial, superpuesta a una onda ordinaria. Es más sensible que la polarografía ordinaria, y la señal se parece mucho a la derivada de una onda polarográficas.
- Polarografía normal de impulsos: técnica polarográfica basada en la aplicación de un impulso de voltaje a cada gota de mercurio en las proximidades del final de su vida. La corriente se mide durante un corto intervalo de tiempo hacia el final de cada impulso. Se reduce el voltaje hasta el final de su línea base en la mayor parte de la vida de cada gota, y se aplica el impulso solo hacía el final de la gota.
- Polarografía paso a paso: polarografía en la cual se aplica al electrodo de gotas de mercurio un potencial que cambia paso a paso, en incrementos discretos iguales y de modo sincronizado con la caída de la gota.
- Polarografía por redisolución anódica: polarografía en la cual el electrodo de gotas de mercurio se sustituye por uno de amalgama, la cual contiene el metal a estudiar.
- Polarografía Tast: polarografía con caída forzada de la gota de mercurio y donde la corriente se registra solamente en la parte final del tiempo de vida de cada gota.
Ventajas y desventajas del electrodo de gotas de mercurio
Ventajas:
- Elevado sobrepotencial para la reducción de H+ (alto límite negativo). Entonces se pueden depositar iones Zn y Cd desde soluciones ácidas.
- Nueva superficie metálica se genera continuamente (se evita comportamiento irregular debido a adsorción de impurezas)
Desventajas:
- Facilidad de oxidación del Hg entonces limita su uso como ánodo. A potenciales mayores de +0.4 V se forma Hg(I). En presencia de especies que formen precipitados o complejos con el Hg(I) el potencial disminuye, por ejemplo con Cloro se forma el cloruro de mercurio Hg2Cl2(s) a 0 V.
- Corriente residual limita la sensibilidad a 10-5 M (aunque se puede mejorar en dos órdenes de magnitud).
- De uso incómodo (se atasca) y el mercurio es tóxico.
Aplicación
- Electrólisis
- Análisis químico elemental,
- Potenciales de ionización,
- Cinética de reacciones electródicas,
- Cálculo del coeficiente de transferencia electródica,
- Reversibilidad e irreversibilidad de procesos,
- Cinética de las reacciones químicas,
- Reconocimiento de componentes químicos de sustancias acuosas,
- Determinación de metales pesados: As, Bi, Cd, Cr, Co, Cu, Fe, Pb, Mg, Mo, Ni, Sb, Se, a niveles de ppt, ppb y ppm.
- Naturaleza de iones complejos,
- Fenómenos de adsorción en el electrodo, entre otros.
Véase también
Fuente
- Métodos electroanalíticos de análisis
- Blog Polarography
- Blog Analítica III
- Delahay, P.; Charlot, G., y Laitinen, H. , Electroanalysis Chemical, Vol. 1, 1960.
- Skoog, Douglas A., West, Donald, M. Análisis Instrumental. Nueva Editorial Interamericana. México, 1992.
- Heyrovsky, J., Chemistry Listy, Vol. 16, Pág. 256, 1922.