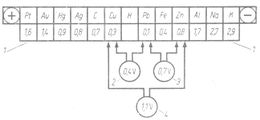
Serie electroquímica
| ||||||
Una serie electroquímica, es la disposición de los elementos, especialmente de los metales, según la magnitud de las diferencias de potencial que se presentan en el límite de fase entre estos elementos y soluciones activas de sus iones. Como quiera que las diferencias de potencial no se pueden medir directamente, se mide la diferencia de potencial del sistema respecto a un electrodo de referencia. para esta finalidad se ha fijado hidrógeno.
Sumario
Qué es una reacción química
Las reacciones de reducción-oxidación son las reacciones de transferencia de electrones. Esta transferencia se produce entre un conjunto de elementos químicos, uno oxidante y uno reductor. En estas reacciones la energía liberada de una reacción espontánea se convierte en electricidad o bien se puede aprovechar para inducir una reacción química no espontánea. Las reacciones químicas en las que se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o, en caso contrario, son producidos como consecuencia de ella.
Características de Serie electroquímica
Es una rama de la química que estudia la transformación entre la energía electrica y la energía química. En otras palabras, las reacciones químicas que se dan en la interfaz de un conductor eléctrico (llamado electrodo, que puede ser un metal o un semiconductor) y un conductor iónico (el electrolito) pudiendo ser una disolución y en algunos casos especiales, un sólido. La definición de E0 (potencial de reducción) para cada uno de los metales y fases permite establecer una primera aproximación de la tendencia a constituirse en ánodo, corrosión, o en cátodo, reducción, de los dos metales que están constituyendo una micro o macropila de corrosión.
Véase también
Fuente
- Diccionario Técnico Electrotecnia. Editorial Científico-técnica, La Habana 1990